Pionierzy w Genetyce: Badacze Ścigają Lek na Rzadkie Choroby Dziedziczne
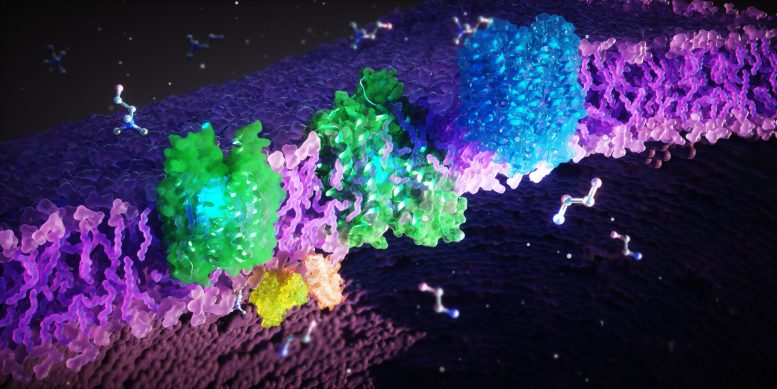
Międzynarodowy zespół zidentyfikował struktury i kluczowe funkcje białek FLVCR1 i FLVCR2, które transportują kluczowe cząsteczki wpływające na zdrowie komórkowe. To badanie zwiększa zrozumienie rzadkich zaburzeń genetycznych związanych z tymi białkami i otwiera drogi do nowych rozwojów terapeutycznych. Białka FLVCR (zielone, niebieskie) znajdują się w błonie komórkowej (fioletowej). Te białka transportują budulce komórkowe etanolaminę i cholinę przez błonę. Autorstwa: Ella Maru Studio
Wiadomo, że nieprawidłowości w funkcjonowaniu białek FLVCR1 i FLVCR2 prowadzą do rzadkich chorób dziedzicznych u ludzi, które powodują zaburzenia motoryczne, sensoryczne i neurologiczne. Jednak dotychczas niejasne były biochemiczne mechanizmy stojące za tym oraz fizjologiczne funkcje białek FLVCR.
Interdyscyplinarny zespół badaczy z Frankfurtu nad Menem, Singapuru i USA odkodował teraz 3D struktury białek FLVCR i ich funkcje komórkowe. Badacze wykazali, że białka te transportują budulce komórkowe cholinę i etanolaminę. Ich odkrycia znacząco przyczyniają się do zrozumienia patogenezy rzadkich chorób i opracowywania nowych terapii.
W szpitalnych serialach telewizyjnych, takich jak Scrubs czy Dr. House, lekarze szukają poprawnych diagnoz i możliwych terapii dla pacjentów z czasem zagadkowymi lub dziwnymi objawami. W rzeczywistości proces ten często trwa lata dla osób dotkniętych rzadkimi chorobami. W wielu przypadkach nie ma skutecznego leku, a opcje terapeutyczne są ograniczone.
Ok. 6-8% populacji świata cierpi na rzadką chorobę. To około 500 milionów osób, mimo że każda z ponad 7000 różnych chorób dotyka tylko około jedną na 2000 osób. Ponieważ te choroby są tak rzadkie, wiedza medyczna i naukowa na ich temat jest ograniczona. Na świecie jest tylko kilka ekspertów, a świadomość społeczna jest niska.
Międzynarodowy zespół badaczy pod kierownictwem Schara Safariana, lidera grupy projektowej w Instytucie Maks Planck z dziedziny biofizyki, a także niezależnego lidera grupy w Instytucie Fraunhofera ds. Medycyny Translacyjnej i Farmakologii ITMP oraz w Instytucie Farmakologii Klinicznej na Uniwersytecie Goethego we Frankfurcie, zbadał strukturę i funkcje komórkowe dwóch białek, FLVCR1 i FLVCR2, które odgrywają kluczową rolę w szeregu rzadkich chorób dziedzicznych. Naukowcy opublikowali swoje odkrycia w prestiżowym czasopiśmie Nature.
Nieprawidłowości w funkcjonowaniu FLVCR1 i FLVCR2 spowodowane mutacjami genów powodują rzadkie choroby, niektóre z nich prowadzą do poważnych zaburzeń wzrokowych, ruchowych i sensorycznych - takich jak ataksja kolumny tylnej z retinitis pigmentosa, zespół Fowlera lub neuropatie czuciowe i autonomiczne. Te ostatnie mogą na przykład prowadzić do całkowitej utraty wrażenia bólu. „W wielu chorobach, w tym rzadkich, struktury komórkowe w naszym ciele ulegają zmianie, co prowadzi do nieprawidłowości w procesach biochemicznych - mówi Schara Safarian. - Aby zrozumieć rozwój takich chorób i opracować terapie, musimy wiedzieć, jak na poziomie molekularnym są zbudowane te białka i jakie funkcje pełnią w zdrowych komórkach”.
Naukowcy odkryli, że FLVCR 1 i FLVCR2 transportują cząsteczki cholinę i etanolaminę przez błony naszych komórek. „Cholina i etanolamina są niezbędne dla ważnych funkcji organizmu. Wspierają wzrost, regenerację i stabilność naszych komórek, na przykład w mięśniach, narządach wewnętrznych i mózgu - wyjaśnia Safarian. - Ponadto, cholina jest zaangażowana w metabolizm tłuszczów i detoksykację przez wątrobę. Nasze ciało potrzebuje jej także do produkcji neuroprzekaźnika acetylocholiny, który jest niezbędny dla naszego układu nerwowego i potrzebny naszemu mózgowi do kontroli narządów. Można więc sobie wyobrazić, że nieprawidłowe działanie białek FLVCR może prowadzić do poważnych zaburzeń neurologicznych i mięśniowych”.
Badacze użyli mikroskopowych, biochemicznych i komputerowych metod do zbadania białek FLVCR. „Szokowo zamrożone białka obserwowaliśmy pod mikroskopem elektronowym - wyjaśnia Di Wu, badaczka z Instytutu Maks Planck z dziedziny biofizyki i współautorka badania. - Wiązka elektronów przenika przez zamrożoną próbkę, a interakcja elektronów z materiałem tworzy obraz”. Badacze wykonują wiele indywidualnych obrazów i przetwarzają je oraz łączą za pomocą komputera, aby uzyskać wysokiej rozdzielczości struktury 3D białek. W ten sposób udało się rozszyfrować struktury FLVCR1 i FLVCR2 oraz zobaczyć, jak zmieniają się one w obecności etanolaminy i choliny. Symulacje komputerowe potwierdziły i zobrazowały, jak białka FLVCR oddziałują z etanolaminą i choliną, oraz dynamicznie zmieniają swoją strukturę, aby umożliwić transport składników odżywczych.
Safarian summarizes: “Our findings pave the way for understanding the development and progression of rare diseases associated with the FLVCR proteins. In the future, patients may be able to benefit from new therapies that restore their life quality.”
Reference: “Molecular mechanism of choline and ethanolamine transport in humans” by Keiken Ri, Tsai-Hsuan Weng, Ainara Claveras Cabezudo, Wiebke Jösting, Yu Zhang, Andre Bazzone, Nancy C. P. Leong, Sonja Welsch, Raymond T. Doty, Gonca Gursu, Tiffany Jia Ying Lim, Sarah Luise Schmidt, Janis L. Abkowitz, Gerhard Hummer, Di Wu, Long N. Nguyen and Schara Safarian, 22 May 2024, Nature. DOI: 10.1038/s41586-024-07444-7




