Wegbereiter der Genetik: Forscher suchen nach dem Heilung für seltene erbliche Krankheiten
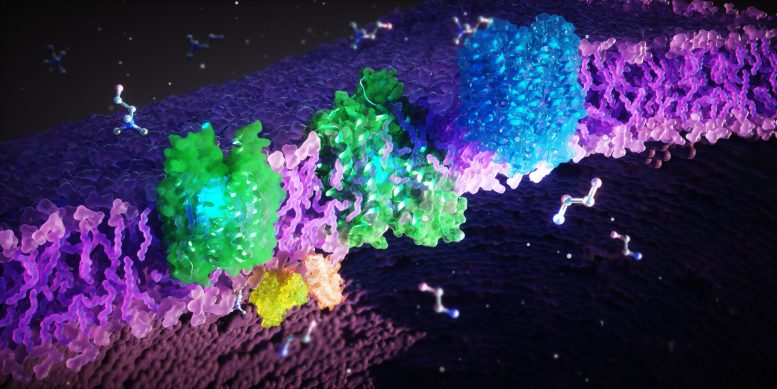
Ein internationales Team hat die Strukturen und entscheidenden Funktionen der Proteine FLVCR1 und FLVCR2 identifiziert, die wichtige Moleküle für die Gesundheit von Zellen transportieren. Diese Forschung verbessert das Verständnis von seltenen genetischen Störungen, die mit diesen Proteinen verbunden sind, und öffnet Wege für neue therapeutische Entwicklungen. Die FLVCR-Proteine (grün, blau) sitzen in der Zellmembran (lila). Diese Proteine transportieren die zellulären Bausteine Ethanolamin und Cholin durch die Membran. Credit: Ella Maru Studio
Es ist bekannt, dass Fehlfunktionen der Proteine FLVCR1 und FLVCR2 zu seltenen Erbkrankheiten beim Menschen führen, die motorische, sensorische und neurologische Störungen verursachen. Die biochemischen Mechanismen dahinter und die physiologischen Funktionen der FLVCR-Proteine waren jedoch bisher unklar.
Ein interdisziplinäres Team von Forschern aus Frankfurt am Main, Singapur und den USA hat nun die 3D-Strukturen und zellulären Funktionen der FLVCR-Proteine entschlüsselt. Die Forscher haben gezeigt, dass die Proteine die zellulären Bausteine Cholin und Ethanolamin transportieren. Ihre Erkenntnisse tragen wesentlich zum Verständnis der Pathogenese seltener Krankheiten und zur Entwicklung neuer Therapien bei.
In Krankenhausfernsehserien wie Scrubs oder Dr. House suchen Mediziner nach korrekten Diagnosen und möglichen Behandlungen für Patienten mit manchmal rätselhaften oder seltsamen Symptomen. In Wirklichkeit dauert dieser Prozess oft Jahre für die von seltenen Krankheiten Betroffenen. In vielen Fällen gibt es keine wirksame Medikation und die therapeutischen Optionen sind begrenzt.
Etwa 6-8% der Weltbevölkerung leiden an einer seltenen Krankheit. Das sind etwa 500 Millionen Menschen, obwohl jede der über 7000 verschiedenen Krankheiten nur etwa einen von 2000 Menschen betrifft. Da diese Krankheiten so selten sind, sind medizinisches und wissenschaftliches Wissen über sie begrenzt. Es gibt nur wenige Experten weltweit und das soziale Bewusstsein fehlt.
Ein internationales Forscherteam unter der Leitung von Schara Safarian, Projektgruppenleiterin am Max-Planck-Institut für Biophysik und selbständige Gruppenleiterin am Fraunhofer-Institut für Translationsmedizin und Pharmakologie ITMP und am Institut für Klinische Pharmakologie an der Goethe-Universität Frankfurt, hat nun die Struktur und zelluläre Funktion von zwei Proteinen, FLVCR1 und FLVCR2, untersucht, die eine kausale Rolle bei einer Reihe von seltenen Erbkrankheiten spielen. Die Wissenschaftler haben ihre Ergebnisse in der renommierten Zeitschrift Nature veröffentlicht.
Funktionsstörungen von FLVCR1 und FLVCR2 durch Genmutationen verursachen seltene Krankheiten, von denen einige zu schweren Seh-, Bewegungs- und Sinnesstörungen führen - wie beispielsweise die hintere Säulenataxie mit Retinitis pigmentosa, das Fowler-Syndrom oder sensorische und autonome Neuropathien. Letztere können beispielsweise zu einem vollständigen Verlust des Schmerzempfindens führen. „Bei vielen Krankheiten, auch bei den seltenen, sind zelluläre Strukturen in unserem Körper verändert und dies führt zu Funktionsstörungen in biochemischen Prozessen“, sagt Schara Safarian. „Um die Entwicklung solcher Krankheiten zu verstehen und Therapien zu entwickeln, müssen wir wissen, wie diese Proteine auf molekularer Ebene strukturiert sind und welche Funktionen sie in gesunden Zellen erfüllen.“
Die Wissenschaftler haben entdeckt, dass FLVCR 1 und FLVCR2 die Moleküle Cholin und Ethanolamin durch die Membranen unserer Zellen transportieren. „Cholin und Ethanolamin sind für wichtige Körperfunktionen unerlässlich. Sie unterstützen das Wachstum, die Regeneration und die Stabilität unserer Zellen, zum Beispiel in Muskeln, inneren Organen und dem Gehirn“, erklärt Safarian. „Außerdem ist Cholin am Fettstoffwechsel und der Entgiftung durch die Leber beteiligt. Unser Körper benötigt es auch zur Produktion des Neurotransmitters Acetylcholin, der für unser Nervensystem unerlässlich ist und von unserem Gehirn zur Steuerung der Organe benötigt wird. Man kann sich also vorstellen, dass Funktionsstörungen der FLVCR-Proteine schwere neurologische und muskuläre Störungen verursachen können.“
Die Forscher nutzten mikroskopische, biochemische und computergestützte Methoden, um die FLVCR-Proteine zu untersuchen. „Wir haben die Proteine schockgefroren und dann unter einem Elektronenmikroskop beobachtet“, erklärt Di Wu, Forscher am Max-Planck-Institut für Biophysik und Mitautor der Studie. „Ein Elektronenstrahl durchdringt die gefrorene Probe und die Wechselwirkung der Elektronen mit dem Material erzeugt ein Bild.“ Die Forscher nehmen viele Einzelbilder auf, verarbeiten sie und kombinieren sie computergestützt, um hochauflösende 3D-Strukturen von Proteinen zu erhalten. Auf diese Weise konnten sie die Strukturen von FLVCR1 und FLVCR2 entschlüsseln und sehen, wie sie sich in Anwesenheit von Ethanolamin und Cholin verändern. Computersimulationen bestätigten und visualisierten, wie die FLVCR-Proteine mit Ethanolamin und Cholin interagieren und ihre Struktur dynamisch verändern, um den Transport von Nährstoffen zu ermöglichen.
Safarian summarizes: “Our findings pave the way for understanding the development and progression of rare diseases associated with the FLVCR proteins. In the future, patients may be able to benefit from new therapies that restore their life quality.”
Reference: “Molecular mechanism of choline and ethanolamine transport in humans” by Keiken Ri, Tsai-Hsuan Weng, Ainara Claveras Cabezudo, Wiebke Jösting, Yu Zhang, Andre Bazzone, Nancy C. P. Leong, Sonja Welsch, Raymond T. Doty, Gonca Gursu, Tiffany Jia Ying Lim, Sarah Luise Schmidt, Janis L. Abkowitz, Gerhard Hummer, Di Wu, Long N. Nguyen and Schara Safarian, 22 May 2024, Nature. DOI: 10.1038/s41586-024-07444-7




