Uno studio rivela un nuovo processo di disregolazione dell'RNA che contribuisce alla neurodegenerazione.
Questo articolo è stato revisionato secondo il processo editoriale e le politiche di Science X. Gli editori hanno evidenziato i seguenti attributi garantendo la credibilità del contenuto:
- fatto verificato
- pubblicazione peer-reviewed
- fonte affidabile
- corretta la bozza
da Ingrid Fadelli, Medical Xpress
Studi recenti di neuroscienze hanno costantemente delineato il ruolo del gene C9ORF72 nello sviluppo di alcune malattie neurodegenerative. Questi studi hanno scoperto che le mutazioni di questo gene aumentano il rischio di sviluppare la sclerosi laterale amiotrofica (SLA) e la demenza frontotemporale (DFT), due disturbi neurodegenerativi caratterizzati da problemi motori, difficoltà di comunicazione e altri sintomi distinti.
Ricercatori della Johns Hopkins University School of Medicine, dell'Università di Chicago, dell'Istituto medico Howard Hughes e di altri istituti negli Stati Uniti hanno recentemente condotto uno studio volto a comprendere meglio i processi attraverso i quali la mutazione del gene C9ORF72 potrebbe contribuire in modo definitivo allo sviluppo di SLA e DFT. I loro risultati, pubblicati su Nature Neuroscience, evidenziano un'avenuta promettente che potrebbe migliorare le terapie per queste complesse patologie neurodegenerative.
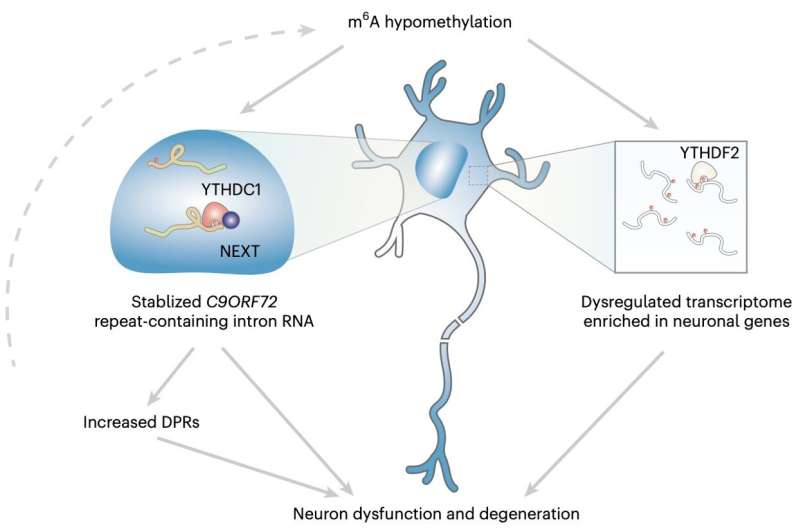
"Il mio gruppo di ricerca si è interessato ad identificare i modificatori del metabolismo dell'RNA ripetuto del C9ORF72", ha detto la dott.ssa Shuying Sun, una delle ricercatrici che ha condotto lo studio, a Medical Xpress. "Un'espansione ripetuta di esanucleotidi nel gene C9ORF72 è la causa genetica più diffusa di entrambe le malattie SLA e DFT. Visto che l'espansione è situata nella regione non codificante, l'RNA contenente la ripetizione è considerato un fattore principale che impulsa la patogenesi della malattia."
Sun e i suoi colleghi hanno cercato di identificare i modificatori genetici della produzione non convenzionale di proteine poli-dipeptidiche tossiche dall'RNA ripetuto. Ciò potrebbe permettere loro di identificare strategie valide per impedire l'accumulazione di queste proteine tossiche e ridurre così i loro effetti dannosi. In uno dei loro studi precedenti, hanno effettuato uno screening genome-wide CRISPR-Cas9 per cercare modificatori genetici della produzione di dipeptidi.
"Abbiamo scoperto che le due metiltrasferasi m6A sono geni candidati che possono modulare il livello di poli-dipeptide", ha spiegato Sun. "Abbiamo anche analizzato dati proteomici pubblici e abbiamo trovato che le due metiltrasferasi sono downregolate nelle iPS-neuroni dei pazienti C9ORF72-ALS/DFT. Nel complesso, questo ha iniziato ulteriormente il nostro studio sull'alterazione della m6A e su come ciò contribuisca alla neurodegenerazione in C9ORF72-ALS/DFT."
Sun e i suoi colleghi hanno effettuato una serie di analisi su neuroni differenziati da cellule staminali pluripotenti indotte (iPSC) ottenuti dai pazienti e su tessuti post mortem estratti da pazienti deceduti con SLA/DFT e mutazioni del gene C9ORF72. Utilizzando varie tecniche di sequenziamento genetico ad alta intensità, hanno valutato specificamente una modifica dell'RNA nota come M6A (metiladenosina) e il suo impatto sulla regolazione dei geni su tutto il range di mRNA espresso, noto come trascritoma.
"Abbiamo anche esaminato il meccanismo molecolare della regolazione m6A sull'RNA ripetuto del C9", ha detto Sun. "Infine, abbiamo misurato la sopravvivenza dei neuroni per esaminare l'efficacia del recupero mediante la modulazione della via m6A. Le nostre scoperte rivelano uno strato nuovo di regolazione dell'RNA che svolge un ruolo critico nel meccanismo patogenetico sottostante la neurodegenerazione."
Nel complesso, i risultati ottenuti da questo team di ricerca hanno mostrato che la modifica m6A nella sequenza genetica C9ORF72 di ripetizioni espandibili facilita la decadimento dell'RNA tramite il recettore nucleare YTHDC1, regolando quindi le ripetizioni. Inoltre, la riduzione di m6A sembra facilitare l'accumulazione di RNA ripetuti e l'encoding di proteine tossiche note per essere associate alla neurodegenerazione.
Aumentando la metilazione m6A, Sun e i suoi colleghi sono riusciti a ridurre significativamente il livello di RNA ripetiti, proteggendo così i neuroni su cui stavano sperimentando e riducendo il loro rischio di decadimento. In futuro, questi risultati potrebbero aprire la strada allo sviluppo di trattamenti più efficaci per SLA e DFT, ad esempio promuovendo studi sull'epitranscriptomica come potenziale intervento terapeutico.
"Vorremmo testare ulteriormente l'efficacia del recupero in vivo utilizzando modelli appropriati di topi", ha aggiunto Sun. "Siamo anche interessati a sviluppare approcci farmaceutici mirati a questa via. Inoltre, speriamo di indagare sui meccanismi delle malattie implicati nel metabolismo dell'RNA e nell'alterazione m6A nella SLA sporadica e in altri disturbi neurologici."
© 2023 Science X Network




