Studie enthüllt neuen RNA-Dysregulationsprozess, der zur Neurodegeneration beiträgt.
Dieser Artikel wurde gemäß dem redaktionellen Prozess und den Richtlinien von Science X überprüft. Die Herausgeber haben bei der Sicherstellung der Glaubwürdigkeit des Inhalts folgende Merkmale hervorgehoben:
- Faktengestützt
- Von Fachkollegen begutachtete Publikation
- Vertrauenswürdige Quelle
- Überprüft
von Ingrid Fadelli, Medical Xpress
Aktuelle neurowissenschaftliche Studien haben kontinuierlich die Rolle des C9ORF72-Gens bei der Entwicklung einiger neurodegenerativer Erkrankungen herausgestellt. Diese Studien haben herausgefunden, dass Mutationen dieses Gens das Risiko für die Entwicklung von amyotropher Lateralsklerose (ALS) und frontotemporaler Demenz (FTD), zwei neurodegenerative Störungen, die durch motorische Beeinträchtigungen, Kommunikationsprobleme und andere charakteristische Symptome gekennzeichnet sind, erhöhen.
Forscher der Johns Hopkins University School of Medicine, der University of Chicago, des Howard Hughes Medical Institute und anderer Institute in den Vereinigten Staaten haben kürzlich eine Studie durchgeführt, um die Prozesse besser zu verstehen, durch die eine Mutation des C9ORF72-Gens letztendlich zur Entwicklung von ALS und FTD beitragen könnte. Ihre Ergebnisse, veröffentlicht in Nature Neuroscience, zeigen eine vielversprechende Möglichkeit auf, therapeutische Eingriffe für diese komplexen neurodegenerativen Erkrankungen zu verbessern.
'Meine Forschungsgruppe hat sich darauf konzentriert, Modifikatoren des C9ORF72-Repeat-RNA-Stoffwechsels zu identifizieren', erklärt Dr. Shuying Sun, eine der Forscherinnen, die die Studie durchgeführt hat, gegenüber Medical Xpress. 'Eine Expansion des Hexanukleotid-Repeats im C9ORF72-Gen ist die häufigste genetische Ursache sowohl von ALS als auch von FTD. Da sich die Expansion im nichtkodierenden Bereich befindet, wird davon ausgegangen, dass die repeat-enthaltende RNA einer der Hauptfaktoren ist, die die Krankheitspathogenese antreiben.'
Sun und ihre Kollegen haben versucht, genetische Modifikatoren der unkonventionellen Produktion von toxischen Polydipeptid-Proteinen aus der Repeat-RNA zu identifizieren. Dadurch könnten sie wiederum erfolgversprechende Strategien identifizieren, um die Akkumulation dieser toxischen Proteine zu verhindern und so ihre toxischen Effekte zu reduzieren. In einer ihrer früheren Studien führten sie daher einen genome-wide CRISPR-Cas9-Screen durch, um nach genetischen Modifikatoren der Dipeptid-Produktion zu suchen.
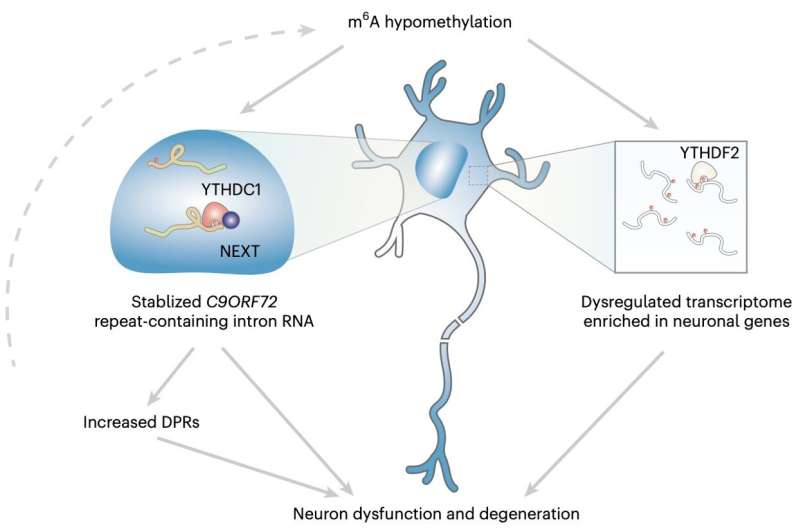
'Wir haben herausgefunden, dass die beiden m6A-Methyltransferasen Kandidatengene sind, die den Polydipeptid-Spiegel modulieren können', erklärt Sun. 'Wir haben auch öffentliche proteomische Daten analysiert und festgestellt, dass die beiden Methyltransferasen in C9ORF72-ALS/FTD-Patienten-iPS-Neuronen herunterreguliert sind. Insgesamt hat dies unsere weitere Untersuchung zur m6A-Dysregulation und wie sie zur Neurodegeneration bei C9ORF72-ALS/FTD beiträgt, initiiert.'
Sun und ihre Kollegen führten eine Reihe von Analysen an aus induzierten pluripotenten Stammzellen (iPSC) differenzierten Neuronen (iPSNs) von Patienten und an Leichengeweben von verstorbenen Patienten mit ALS/FTD und C9ORF72-Genmutationen durch. Mit verschiedenen hochdurchsatzgenetischen Sequenzierungstechniken untersuchten sie speziell eine RNA-Modifikation namens M6A (Methyladenosin) und ihre Auswirkung auf die Regulation von Genen im gesamten Spektrum der exprimierten Boten-RNA (mRNA), bekannt als Transkriptom.
'Wir haben auch den molekularen Mechanismus der m6A-Regulation an der C9-Repeat-RNA untersucht', sagt Sun. 'Schließlich haben wir die Neuronenüberlebensfähigkeit gemessen, um die Wirkung der Modulation des m6A-Weges zu untersuchen. Unsere Ergebnisse enthüllen eine neuartige Schicht der RNA-Regulation, die eine entscheidende Rolle im pathogenen Mechanismus der Neurodegeneration spielt.'
Insgesamt zeigten die Ergebnisse des Forschungsteams, dass die m6A-Modifikation in der C9ORF72-Genfolge von erweiterten Repeats den Abbau der RNA über den nuklearen Leser YTHDC1 erleichterte und dadurch die Repeats regulierte. Darüber hinaus schien eine Reduktion von m6A die Akkumulation von Repeats-RNAs und die Kodierung von toxischen Proteinen, die mit der Neurodegeneration in Verbindung stehen, zu begünstigen.
Indem sie die m6A-Methylierung erhöhten, konnten Sun und ihre Kollegen das Niveau der Repeats-RNAs signifikant reduzieren und die von ihnen untersuchten Neuronen schützen sowie das Risiko ihres Abbaus verringern. In Zukunft könnten diese Ergebnisse den Weg für die Entwicklung wirksamerer Behandlungen von ALS und FTD ebnen, beispielsweise durch die Durchführung von Studien zur Bewertung des Wertes der epitranskriptomischen Therapie als potenzieller Intervention.
'Wir möchten die Rettungswirksamkeit auch in vivo anhand geeigneter Mausmodelle weiter testen', fügt Sun hinzu. 'Außerdem interessieren wir uns für die Entwicklung pharmazeutischer Ansätze, die diesen Weg ansprechen. Darüber hinaus hoffen wir, die zugrundeliegenden Krankheitsmechanismen, die mit dem RNA-Stoffwechsel und der m6A-Dysregulation bei sporadischer ALS und anderen neurologischen Störungen zusammenhängen, weiter zu untersuchen.'
© 2023 Science X Network




