Étude révèle un nouveau processus de dysrégulation de l'ARN qui contribue à la neurodégénérescence.
Cet article a été examiné selon le processus éditorial et les politiques de Science X. Les éditeurs ont souligné les attributs suivants tout en garantissant la crédibilité du contenu :
- vérification des faits
- publication évaluée par des pairs
- source de confiance
- relecture
par Ingrid Fadelli , Medical Xpress
Des études récentes en neurosciences ont constamment mis en évidence le rôle du gène C9ORF72 dans le développement de certaines maladies neurodégénératives. Ces études ont découvert que les mutations de ce gène augmentent le risque de développer la sclérose latérale amyotrophique (SLA) et la démence frontotemporale (DFT), deux troubles neurodégénératifs caractérisés par des déficiences motrices, des problèmes de communication et d'autres symptômes distincts.
Des chercheurs de l'école de médecine de l'université Johns Hopkins, de l'université de Chicago, de l'institut médical Howard Hughes et d'autres instituts aux États-Unis ont récemment réalisé une étude visant à mieux comprendre les processus par lesquels la mutation du gène C9ORF72 pourrait finalement contribuer au développement de la SLA et de la DFT. Leurs résultats, publiés dans la revue Nature Neuroscience, mettent en évidence une voie prometteuse qui pourrait améliorer les interventions thérapeutiques pour ces troubles neurodégénératifs complexes.
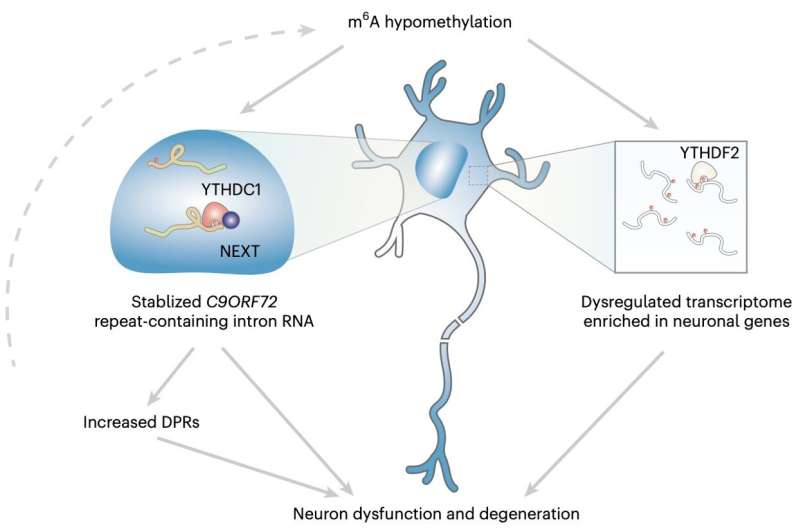
« Mon groupe de recherche s'est intéressé à l'identification des modificateurs du métabolisme de l'ARN répété de C9ORF72 », explique le Dr Shuying Sun, l'une des chercheuses ayant réalisé l'étude, à Medical Xpress. « Une expansion répétée à hexanucléotide dans le gène C9ORF72 est la cause génétique la plus répandue à la fois de la SLA et de la DFT. Comme l'expansion est située dans la région non codante, on pense que l'ARN contenant la répétition est l'un des principaux facteurs qui contribuent à la pathogenèse de la maladie. »
Sun et ses collègues cherchent à identifier des modificateurs génétiques de la production non conventionnelle de protéines poly-dipeptides toxiques à partir de l'ARN répété. Ce faisant, ils pourraient trouver des stratégies viables pour prévenir l'accumulation de ces protéines toxiques et ainsi réduire leurs effets toxiques. Dans l'une de leurs études précédentes, ils ont donc réalisé un dépistage CRISPR-Cas9 à l'échelle du génome pour rechercher des modificateurs génétiques de la production de dipeptides.
« Nous avons découvert que les deux m6A méthyltransférases sont des gènes candidats pouvant moduler le niveau de poly-dipeptide », explique Sun. « Nous avons également analysé des données protéomiques publiques et avons constaté que les deux méthyltransférases sont régulées à la baisse dans les neurones iPS de patients atteints de SLA/DFT liée à C9ORF72. Tout cela a initié notre étude ultérieure sur la dysrégulation de m6A et sur la contribution de celle-ci à la neurodégénérescence dans la SLA/DFT liée à C9ORF72. »
Sun et ses collègues ont réalisé une série d'analyses sur des neurones différenciés à partir de cellules souches pluripotentes induites (CSPI) dérivées de patients et sur des tissus post-mortem de patients décédés atteints de SLA/DFT avec des mutations du gène C9ORF72. À l'aide de différentes techniques de séquençage génétique à haut débit, ils ont spécifiquement évalué une modification de l'ARN appelée M6A (méthyladénosine) et son impact sur la régulation des gènes dans l'ensemble des ARN messagers exprimés, connus sous le nom de transcriptome.
« Nous avons également examiné le mécanisme moléculaire de la régulation de l'ARN répété C9 par la m6A », explique Sun. « Enfin, nous avons mesuré la survie des neurones pour examiner l'efficacité du sauvetage en modulant la voie de la m6A. Nos résultats révèlent un nouveau niveau de régulation de l'ARN qui joue un rôle critique dans le mécanisme pathogène de la neurodégénérescence. »
En résumé, les résultats obtenus par cette équipe de recherche ont montré que la modification m6A de la séquence génétique C9ORF72 des répétitions étendues facilitait la dégradation de l'ARN via le lecteur nucléaire YTHDC1, régulant ainsi les répétitions. De plus, la diminution de la m6A semblait faciliter l'accumulation des ARN répétés et l'encodage de protéines toxiques associées à la neurodégénérescence.
En augmentant la méthylation de la m6A, Sun et ses collègues ont pu réduire significativement le niveau d'ARN répétés, protégeant ainsi les neurones sur lesquels ils ont effectué des expériences et réduisant leur risque de dégradation. À l'avenir, ces résultats pourraient ouvrir la voie au développement de traitements plus efficaces pour la SLA et la DFT, par exemple en incitant à des essais évaluant l'efficacité de la thérapie épitranscriptomique en tant qu'intervention potentielle.
« Nous aimerions également tester l'efficacité du sauvetage in vivo en utilisant des modèles murins appropriés », ajoute Sun. « Nous sommes également intéressés par le développement d'approches pharmaceutiques ciblant cette voie. De plus, nous espérons étudier les mécanismes sous-jacents des maladies impliquant le métabolisme de l'ARN et la dysrégulation de la m6A dans la SLA sporadique et d'autres troubles neurologiques. »
© 2023 Science X Network




