Estudio revela nuevo proceso de disfunción del ARN que contribuye a la neurodegeneración.
Este artículo ha sido revisado de acuerdo con el proceso editorial y las políticas de Science X. Los editores han resaltado las siguientes características al garantizar la credibilidad del contenido:
- verificación de hechos
- publicación revisada por pares
- fuente confiable
- corrección de pruebas
por Ingrid Fadelli, Medical Xpress
Estudios recientes de neurociencia han descrito de manera constante el papel del gen C9ORF72 en el desarrollo de algunas enfermedades neurodegenerativas. Estos estudios encontraron que las mutaciones en este gen aumentan el riesgo de desarrollar esclerosis lateral amiotrófica (ELA) y demencia frontotemporal (DFT), dos trastornos neurodegenerativos caracterizados por problemas motores, dificultades de comunicación y otros síntomas distintos.
Investigadores de la Escuela de Medicina de la Universidad Johns Hopkins, la Universidad de Chicago, el Instituto Médico Howard Hughes y otros institutos en Estados Unidos llevaron a cabo recientemente un estudio con el objetivo de comprender mejor los procesos a través de los cuales la mutación del gen C9ORF72 podría contribuir en última instancia al desarrollo de la ELA y la DFT. Sus hallazgos, publicados en Nature Neuroscience, destacan una vía prometedora que podría mejorar las intervenciones terapéuticas para estos complejos trastornos neurodegenerativos.
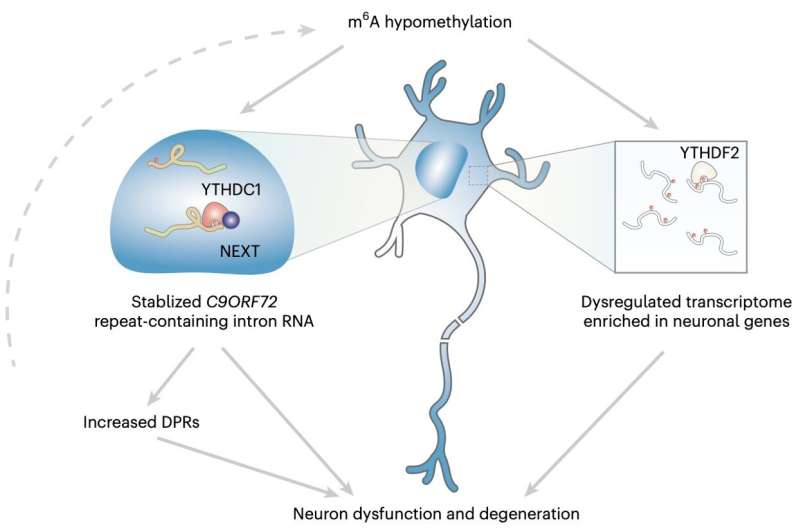
'Mi grupo de investigación ha estado interesado en identificar modificadores del metabolismo del ARN repetido de C9ORF72', dijo la Dra. Shuying Sun, una de las investigadoras que realizó el estudio, a Medical Xpress. 'Una expansión de hexanucleótidos repetidos en el gen C9ORF72 es la causa genética más prevalente tanto de la ELA como de la DFT. Dado que la expansión se encuentra en la región no codificante, se cree que el ARN que contiene la repetición es uno de los principales factores que impulsan la patogénesis de la enfermedad'.
Sun y sus colegas han estado tratando de identificar modificadores genéticos de la producción no convencional de proteínas tóxicas de poli-dipéptidos a partir del ARN repetido. Esto les permitiría identificar estrategias viables para prevenir la acumulación de estas proteínas tóxicas y, por lo tanto, reducir sus efectos tóxicos. En uno de sus estudios anteriores, realizaron un análisis genómico completo utilizando CRISPR-Cas9 para buscar modificadores genéticos de la producción de dipéptidos.
'Encontramos que los dos metiltransferasas m6A son genes candidatos que pueden modular el nivel de poli-dipéptidos', explicó Sun. 'También analizamos datos proteómicos públicos y encontramos que las dos metiltransferasas están reguladas a la baja en las neuronas iPS de pacientes con ELA/DFT-C9ORF72. En conjunto, esto inició nuestro estudio adicional sobre la desregulación de la m6A y cómo esto contribuye a la neurodegeneración en la ELA/DFT-C9ORF72'
Sun y sus colegas realizaron una serie de análisis en neuronas inducidas pluripotentes (iPSN) derivadas de células madre pluripotentes inducidas (iPSC) de pacientes y en tejidos postmortem extraídos de pacientes fallecidos con ELA/DFT y con mutaciones del gen C9ORF72. Utilizando diversas técnicas de secuenciación genética de alto rendimiento, evaluaron específicamente una modificación del ARN conocida como M6A (metiladenosina) y su impacto en la regulación de genes en todo el rango completo de ARN mensajero (mARN) expresado, conocido como transcriptoma.
'También examinamos el mecanismo molecular de la regulación de la m6A en el ARN repetitivo de C9', dijo Sun. 'Finalmente, medimos la supervivencia de las neuronas para examinar la eficacia de rescate al modular la vía de la m6A. Nuestros hallazgos revelan una nueva capa de regulación del ARN que juega un papel crítico en el mecanismo patogénico subyacente a la neurodegeneración'.
En general, los hallazgos obtenidos por este equipo de investigación mostraron que la modificación m6A en la secuencia genética de repeticiones expandidas de C9ORF72 facilitó la degradación del ARN a través del lector nuclear YTHDC1, regulando así las repeticiones. Además, la reducción de la m6A pareció facilitar la acumulación de ARN repetidos y la codificación de proteínas tóxicas asociadas a la neurodegeneración.
Al aumentar la metilación de la m6A, Sun y sus colegas lograron reducir significativamente el nivel de ARN repetidos, protegiendo las neuronas en las que experimentaban y reduciendo su riesgo de degradación. En el futuro, estos resultados podrían allanar el camino hacia el desarrollo de tratamientos más efectivos para la ELA y la DFT, por ejemplo, provocando ensayos que evalúen el valor de la terapia epitranscriptómica como posible intervención.
'Nos gustaría probar aún más la eficacia de rescate in vivo utilizando modelos de ratón apropiados', agregó Sun. 'También estamos interesados en desarrollar enfoques farmacológicos dirigidos a esta vía. Además, esperamos investigar los mecanismos subyacentes de la enfermedad que involucran el metabolismo del ARN y la desregulación de la m6A en la ELA esporádica y otros trastornos neurológicos'.
© 2023 Science X Network




