Selenoproteiny otwierają nowe strategie leczenia pewnych nowotworów u dzieci.
16 listopada 2024 roku
Ten artykuł został sprawdzony zgodnie z procesem redakcyjnym i zasadami Science X. Redaktorzy podkreślili następujące cechy, dbając jednocześnie o wiarygodność treści:
- Sprawdzone pod kątem faktów
- Publikacja z recenzją innych naukowców
- Zaufane źródło
- Skorygowane literówki
przez Uniwersytet w Würzburgu
Selenoproteiny są kluczowe dla kilku funkcji biologicznych, w tym rozkładu szkodliwych substancji, wsparcia dla układu immunologicznego i regulacji procesów metabolicznych. Jednakże w konkretnych kontekstach te białka mogą być wykorzystane i chronić komórki nowotworowe przed śmiercią. Jednym z takich białek jest peroksydaza glutationu 4 (GPX4), kluczowe w wspieraniu ochrony komórek i przeżycia komórek nowotworowych.
„Ta właściwość ochronna GPX4 stanowi poważne wyzwanie dla standardowych terapii nowotworowych, ponieważ jej aktywność została wykazana jako promująca przeżycie stanów tolerancji na leki” - mówi profesor Pedro Friedmann Angeli, kierownik Katedry Biologii Komórkowej Translacyjnej na Uniwersytecie Würzburga (JMU) w Niemczech.
„Jeżeli jednak zdołamy zahamować produkcję GPX4, możemy być w stanie skierować się do zniszczenia komórek nowotworowych. Jest to szczególnie obiecujące w leczeniu neuroblastoma, który dotyka głównie dzieci.”
Wspólnie z naukowcami z Instytutu Technologii Komórek Macierzystych i Medycyny Doświadczalnej w Heidelbergu pod przewodnictwem lidera zespołu juniorów, Hameda Alborzinii, zespół Friedmanna Angeli skupia się zatem na badaniach nad hamowaniem enzymów sprzyjających insercji selenocyteiny w selenoproteiny.
Artykuł został opublikowany w czasopiśmie „Molecular Cell”.
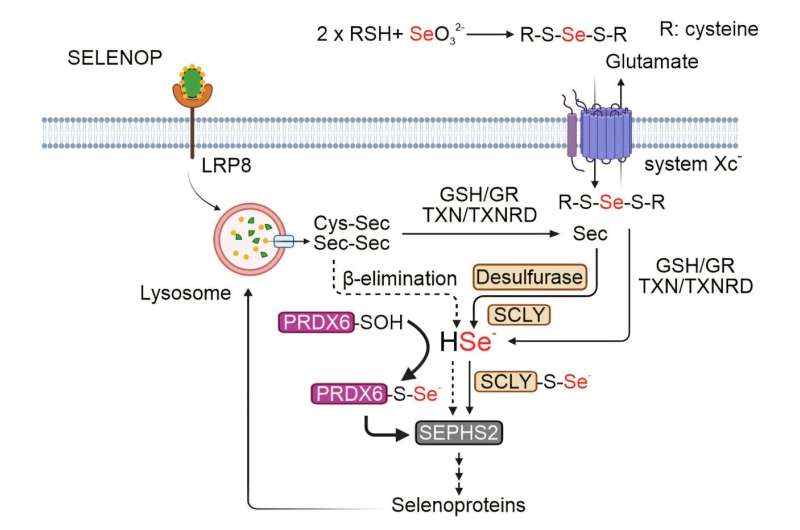
„Do tej pory znaliśmy tylko jeden enzym, selenocyteinazę (SCLY), odpowiedzialny za uwolnienie atomu selenu z selenocyteiny” - wyjaśnia Zhiyi Chen, student doktorancki w zespole Friedmanna Angeli i pierwszy autor badania.
„Nasze badania wykazały obecność nieoczekiwanej ścieżki, która wymaga złożenia peroksyredoksyny 6 (PRDX6), która może utrzymać produkcję selenoprotein bez SCLY.”
Dzięki zaawansowanym technikom, takim jak spektrometria mas i funkcjonalna genomika oparta na CRISPR-Cas9, zespół badawczy odkrył, że PRDX6 łączy się bezpośrednio z selenem i działa jako transporter, czyli „statek,” dla tego pierwiastka, umożliwiając produkcję nowych selenoprotein. Badanie wykazało również, że hamowanie PRDX6 może osłabić przeżycie komórek nowotworowych, zwłaszcza w neuroblastomie, oferując nowy potencjalny cel terapeutyczny.
Co ciekawe, zespół odkrył, że mimo że PRDX6 może zrekompensować brak SCLY, brakuje mu specyficznej aktywności obecnej w SCLY, potrzebnej do uwolnienia atomu selenu z jego prekursorów. Grupa Friedmanna Angeli zamierza zbadać, z którymi innymi białkami współpracuje PRDX6, aby utrzymać syntezę selenoprotein. Ponadto, rozwój inhibitorów molekularnych mających na celu zahamowanie zarówno SCLY, jak i PRDX6 znajduje się w planach, mając na celu skuteczniejsze hamowanie wzrostu komórek nowotworowych.
Badanie było kollaboracją, biorącą udział partnerów z Uniwersytetu w São Paulo w Brazylii, Instytutu Technologii Komórek Macierzystych i Medycyny Doświadczalnej w Heidelbergu oraz Niemieckiego Centrum Badań nad Nowotworami.
Więcej informacji: Zhiyi Chen et al, PRDX6 contributes to selenocysteine metabolism and ferroptosis resistance, Molecular Cell (2024). DOI: 10.1016/j.molcel.2024.10.027
Informacje o czasopiśmie: Molecular Cell
Dostarczone przez Uniwersytet w Würzburgu




