Las selenoproteínas abren nuevas estrategias para tratar ciertos cánceres en niños.
16 de noviembre de 2024
Este artículo ha sido revisado de acuerdo con el proceso editorial y políticas de Science X. Editores han resaltado las siguientes atributos mientras aseguran la credibilidad del contenido:
- verificado por hechos
- publicación revisada por pares
- fuente confiable
- corregido
por Universidad de Würzburg
Las selenoproteínas son cruciales para varias funciones biológicas, incluyendo la descomposición de sustancias dañinas, el apoyo al sistema inmunológico y la regulación de procesos metabólicos. Sin embargo, en contextos específicos, estas proteínas pueden ser mal utilizadas y proteger a las células cancerosas de la muerte. Una de estas proteínas, la glutatión peroxidasa 4 (GPX4), es vital para proteger las células y la supervivencia de las células cancerosas.
"Esta propiedad protectora de GPX4 crea un desafío significativo para las terapias estándar contra el cáncer, ya que su actividad ha demostrado promover la supervivencia de estados tolerantes a fármacos", dice el profesor Pedro Friedmann Angeli, presidente de Biología Celular Translacional en la Universidad de Würzburg (JMU), Alemania.
"Pero si podemos inhibir la producción de GPX4, podríamos ser capaces de atacar y destruir las células cancerosas. Esto es especialmente prometedor para tratar el neuroblastoma, que afecta principalmente a niños."
Junto con investigadores del Instituto de Tecnología de Células Madre y Medicina Experimental de Heidelberg liderados por el líder de grupo junior Hamed Alborzinia, el equipo de Friedmann Angeli se está enfocando en la investigación de la inhibición de enzimas que promueven la inserción de selenocisteína en selenoproteínas.
El artículo se publica en la revista Molecular Cell.
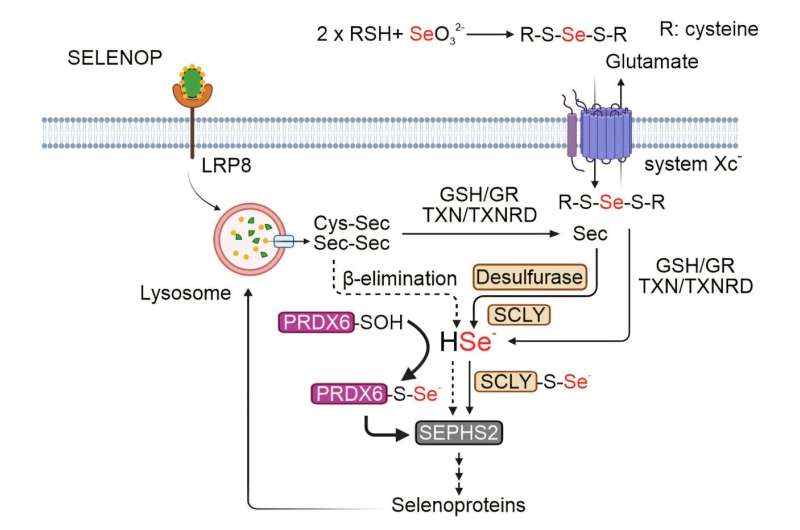
"Hasta ahora, solo conocíamos una enzima, la selenocisteína liasa (SCLY), que era responsable de liberar el átomo de selenio de la selenocisteína", explica Zhiyi Chen, estudiante de doctorado en el equipo de Friedmann Angeli y autor principal del estudio.
"Nuestra investigación ha identificado ahora una vía inesperada que requiere la enzima, peroxirredoxina 6 (PRDX6), que puede mantener la producción de selenoproteínas sin necesidad de SCLY."
A través de técnicas de vanguardia como la espectrometría de masas y la genómica funcional basada en CRISPR-Cas9, el equipo de investigación descubrió que PRDX6 se une directamente al selenio y actúa como un transportador, o 'lanzadera', para el oligoelemento, permitiendo la producción de nuevas selenoproteínas. El estudio también demostró que inhibir PRDX6 podría dañar la supervivencia de las células cancerosas, especialmente en neuroblastomas, ofreciendo un nuevo objetivo terapéutico potencial.
Interesantemente, el equipo encontró que aunque PRDX6 puede compensar la ausencia de SCLY, carece de la actividad específica presente en SCLY necesaria para eliminar el átomo de selenio de sus precursores. El grupo de Friedmann Angeli tiene como objetivo investigar qué otras proteínas colaboran con PRDX6 para mantener la síntesis de proteínas de selenio. Además, el desarrollo de inhibidores moleculares que apunten tanto a SCLY como a PRDX6 está en el horizonte, con el objetivo de obstaculizar mejor el crecimiento de las células cancerosas.
El estudio fue colaborativo, con participación de socios de la Universidad de São Paulo en Brasil, el Instituto de Tecnología de Células Madre y Medicina Experimental en Heidelberg y el Centro Alemán de Investigación contra el Cáncer (DKFZ).
Más información: Zhiyi Chen et al, PRDX6 contribuye al metabolismo de la selenocisteína y la resistencia a la ferroptosis, Molecular Cell (2024). DOI: 10.1016 / j.molcel.2024.10.027
Información de la revista: Molecular Cell
Proporcionado por Universidad de Würzburg




