Les sélénoprotéines ouvrent de nouvelles stratégies pour traiter certains cancers chez les enfants
16 novembre 2024
Cet article a été examiné selon le processus éditorial et les politiques de Science X. Les éditeurs ont mis en évidence les attributs suivants tout en garantissant la crédibilité du contenu :
- vérifiés par des faits
- publication évaluée par des pairs
- source de confiance
- corrigé par des professionnels
par l'Université de Würzburg
Les sélénoprotéines sont cruciales pour plusieurs fonctions biologiques, y compris la dégradation de substances nocives, le soutien du système immunitaire et la régulation des processus métaboliques. Cependant, dans des contextes spécifiques, ces protéines peuvent être détournées et protéger les cellules cancéreuses de la mort. Une de ces protéines, la glutathion peroxydase 4 (GPX4), est essentielle pour la protection cellulaire et la survie des cellules cancéreuses.
"Cette propriété protectrice de GPX4 pose un défi important pour les thérapies contre le cancer standard, car son activité a été démontrée pour favoriser la survie des états tolérants aux médicaments," explique le professeur Pedro Friedmann Angeli, directeur de la biologie cellulaire translationnelle à l'Université de Würzburg (JMU), en Allemagne.
"Mais si nous pouvons inhiber la production de GPX4, nous pourrions être en mesure de cibler et détruire les cellules cancéreuses. Cela est particulièrement prometteur pour traiter le neuroblastome, qui affecte principalement les enfants."
En collaboration avec des chercheurs de l'Institut de Heidelberg pour la technologie des cellules souches et la médecine expérimentale dirigé par le chef de groupe junior Hamed Alborzinia, l'équipe de Friedmann Angeli se concentre donc sur la recherche sur l'inhibition des enzymes qui favorisent l'insertion de la sélénocystéine dans les sélénoprotéines.
L'article est publié dans la revue Cellulaire Moléculaire.
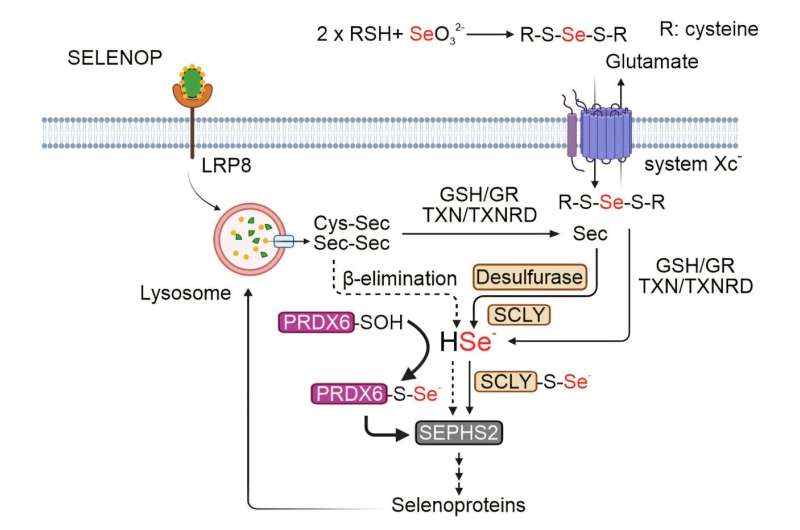
"Jusqu'à présent, nous ne connaissions qu'une seule enzyme, la sélénocystéine lyase (SCLY), qui était responsable de la libération de l'atome de sélénium de la sélénocystéine," explique Zhiyi Chen, étudiant en doctorat dans l'équipe de Friedmann Angeli et premier auteur de l'étude.
"Notre recherche a identifié un chemin inattendu qui requiert l'enzyme, la peroxiredoxine 6 (PRDX6), qui peut maintenir la production de sélénoprotéines sans SCLY."
Grâce à des techniques de pointe telles que la spectrométrie de masse et la génomique fonctionnelle basée sur CRISPR-Cas9, l'équipe de recherche a découvert que PRDX6 se lie directement au sélénium et agit comme un transporteur, ou 'navette', pour l'élément trace, permettant la production de nouvelles sélénoprotéines. L'étude a également démontré que l'inhibition de PRDX6 pourrait compromettre la survie des cellules cancéreuses, en particulier dans les neuroblastomes, offrant ainsi une nouvelle cible thérapeutique potentielle.
De manière intéressante, l'équipe a découvert que bien que PRDX6 puisse compenser l'absence de SCLY, il lui manque l'activité spécifique présente dans SCLY nécessaire pour retirer l'atome de sélénium de ses précurseurs. Le groupe de Friedmann Angeli vise à étudier quels autres protéines collaborent avec PRDX6 pour maintenir la synthèse des protéines au sélénium. De plus, le développement d'inhibiteurs moléculaires ciblant à la fois SCLY et PRDX6 est à l'horizon, dans le but de mieux entraver la croissance des cellules cancéreuses.
L'étude était collaborative, impliquant des partenaires de l'Université de São Paulo au Brésil, de l'Institut de technologie des cellules souches et de la médecine expérimentale à Heidelberg, et du Centre de recherche sur le cancer allemand (DKFZ).
Plus d'informations : Zhiyi Chen et al, PRDX6 contribue au métabolisme de la sélénocystéine et résistance à la ferroptose, Cellulaire Moléculaire (2024). DOI: 10.1016/j.molcel.2024.10.027
Informations sur la revue : Cellulaire Moléculaire
Fourni par L'Université de Würzburg




