Selenoproteine eröffnen neue Strategien zur Behandlung bestimmter Krebsarten bei Kindern
16. November 2024
Dieser Artikel wurde gemäß dem redaktionellen Prozess und den Richtlinien von Science X überprüft. Die Redakteure haben die folgenden Eigenschaften hervorgehoben, während sie die Glaubwürdigkeit des Inhalts sicherstellten:
- überprüfte Fakten
- peer-reviewed Veröffentlichung
- vertrauenswürdige Quelle
- korrekturgelesen
von Universität Würzburg
Selenoproteine sind entscheidend für verschiedene biologische Funktionen, darunter der Abbau von schädlichen Substanzen, die Unterstützung des Immunsystems und die Regulation metabolischer Prozesse. In bestimmten Kontexten können diese Proteine jedoch missbraucht werden und Krebszellen vor dem Tod schützen. Ein solches Protein, Glutathionperoxidase 4 (GPX4), ist entscheidend für den zellulären Schutz und das Überleben von Krebszellen.
"Diese schützende Eigenschaft von GPX4 stellt eine bedeutende Herausforderung für herkömmliche Krebstherapien dar, da gezeigt wurde, dass seine Aktivität das Überleben von medikamententoleranten Zuständen fördert", sagt Professor Pedro Friedmann Angeli, Leiter der Translationellen Zellbiologie an der Universität Würzburg (JMU), Deutschland.
"Aber wenn wir die Produktion von GPX4 hemmen können, könnten wir in der Lage sein, Krebszellen gezielt anzugreifen und zu zerstören. Dies ist besonders vielversprechend für die Behandlung von Neuroblastomen, die hauptsächlich Kinder betreffen."
Gemeinsam mit Forschern des Heidelberger Instituts für Stammzellentechnologie und Experimentelle Medizin unter der Leitung des Junior-Gruppenleiters Hamed Alborzinia konzentriert sich Friedmann Angelis Team daher auf die Erforschung der Hemmung von Enzymen, die die Insertion von Selenocystein in Selenoproteine fördern.
Der Artikel wurde im Journal Molecular Cell veröffentlicht.
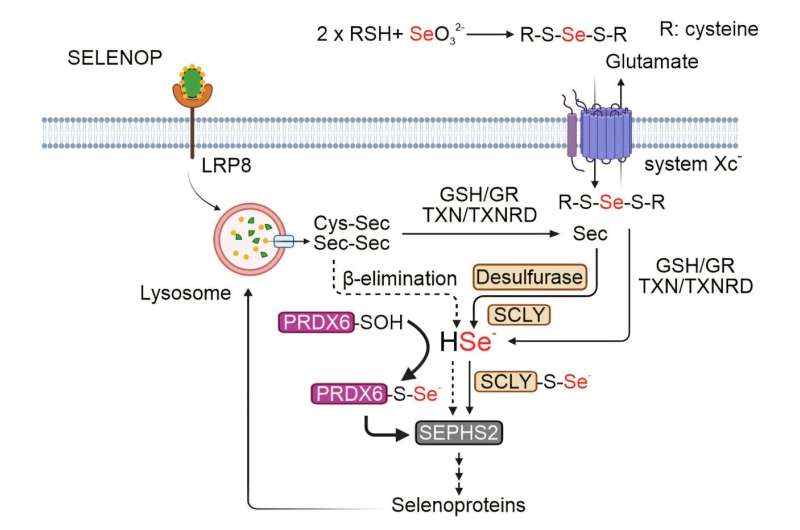
"Bisher kannten wir nur ein Enzym, Selenocystein-Lyase (SCLY), das für die Freisetzung des Selenatoms aus Selenocystein verantwortlich war", erklärt Zhiyi Chen, Doktorandin im Team von Friedmann Angeli und Erstautor der Studie.
"Unsere Forschung hat nun einen unerwarteten Weg identifiziert, der das Enzym Peroxiredoxin 6 (PRDX6) erfordert, das die Selenoproteinproduktion ohne SCLY aufrechterhalten kann."
Durch modernste Techniken wie Massenspektrometrie und CRISPR-Cas9-basierte funktionale Genomik entdeckte das Forschungsteam, dass PRDX6 direkt an Selen gebunden und als Transporter oder 'Shuttle' für das Spurenelement funktioniert, um die Produktion neuer Selenoproteine zu ermöglichen. Die Studie zeigte auch, dass die Hemmung von PRDX6 das Überleben von Krebszellen beeinträchtigen könnte, insbesondere bei Neuroblastomen, und somit ein neues potenzielles therapeutisches Ziel darstellt.
Interessanterweise fand das Team heraus, dass PRDX6 zwar den Mangel an SCLY ausgleichen kann, jedoch nicht über die spezifische Aktivität von SCLY verfügt, die erforderlich ist, um das Selenatom von seinen Vorläufern zu entfernen. Friedmann Angelis Gruppe beabsichtigt, zu untersuchen, welche anderen Proteine mit PRDX6 zusammenarbeiten, um die Synthese von Selenproteinen aufrechtzuerhalten. Darüber hinaus steht die Entwicklung von molekularen Inhibitoren, die sowohl auf SCLY als auch auf PRDX6 abzielen, kurz bevor, um das Wachstum von Krebszellen besser zu hemmen.
Die Studie war kooperativ und umfasste Partner von der Universität São Paulo in Brasilien, dem Institut für Stammzellentechnologie und Experimentelle Medizin in Heidelberg sowie dem Deutschen Krebsforschungszentrum (DKFZ).
Mehr Informationen: Zhiyi Chen et al, PRDX6 trägt zur Selenocystein-Metabolismus und Ferroptose-Resistenz bei, Molecular Cell (2024). DOI: 10.1016/j.molcel.2024.10.027
Journal-Information: Molecular Cell
Bereitgestellt von: Universität Würzburg




