Het najagen van een cellulaire 'kortsluiting' werpt licht op hoe bepaalde ziekten beginnen
4 juni 2024
Dit artikel is beoordeeld volgens het redactionele proces en beleid van Science X. De redacteuren hebben de volgende kenmerken benadrukt bij het waarborgen van de geloofwaardigheid van de inhoud:
- gecontroleerd op feiten
- beoordeeld door vakgenoten
- betrouwbare bron
- nagelezen
door University of California - San Diego
Een groep onderzoekers van de University of California San Diego heeft de oorzaak van een 'kortsluiting' in cellulaire paden geïdentificeerd, een ontdekking die nieuw licht werpt op de ontstaanswijze van een aantal menselijke ziekten.
De recente studie, gepubliceerd in het tijdschrift Science Signaling, onderzoekt het biochemische mechanisme dat de cellulaire communicatieketen kan onderbreken - een verstorende interactie die Pradipta Ghosh, M.D., vergelijkt met een spelbeëindigende 'zoemer'.
Ghosh, een professor in de afdelingen Geneeskunde en Cellulaire en Moleculaire Geneeskunde van de Universiteit van Californië - School voor Geneeskunde in San Diego, en Irina Kufareva, Ph.D., een universitair hoofddocent aan de Skaggs School voor Farmacie en Farmaceutische Wetenschappen aan de Universiteit van Californië - San Diego, zijn de corresponderende auteurs van het artikel.
Het document legt het mechanisme van 'cross-talk' uit tussen twee cellulaire paden, een geïnitieerd door eiwitten die bekend staan als groeifactoren en een door hun cellulaire receptoren. Het tweede pad wordt bemiddeld door een totaal andere G-proteïne-gekoppelde set van cellulaire receptoren (GPCR's). Beide klassen van receptoren bezorgen moleculaire berichten van buiten naar binnen in de cel en geven het signaal aan cellen om op de een of andere manier te veranderen. Kufareva zegt dat leden van de GPCR-familie doelwitten zijn van ongeveer 34% van alle door de Amerikaanse Food and Drug Administration goedgekeurde medicijnen.
'GPCR's zijn vooral belangrijke doelwitten voor geneesmiddelen vanwege hun betrokkenheid bij signaalpaden die gerelateerd zijn aan vele ziekten', legt ze uit, waarbij ze mentale en endocrinologische stoornissen, virale infecties, cardiovasculaire en inflammatoire aandoeningen en zelfs kanker noemt.
Groeifactoren maken een tweede, even belangrijk communicatiepad in de cel mogelijk dat de cellen laat groeien en delen. Terwijl GPCR's werken via intracellulaire moleculaire schakelaars (G-eiwitten), wordt over het algemeen gedacht dat groeifactorreceptoren de schakelaars omzeilen. Ghosh en Kufareva merken echter op dat onderzoekers verdacht waren op een soort potentieel conflict tussen de twee paden, en zorgvuldig onderzoek stelde het team van UC San Diego in staat om dit te identificeren.
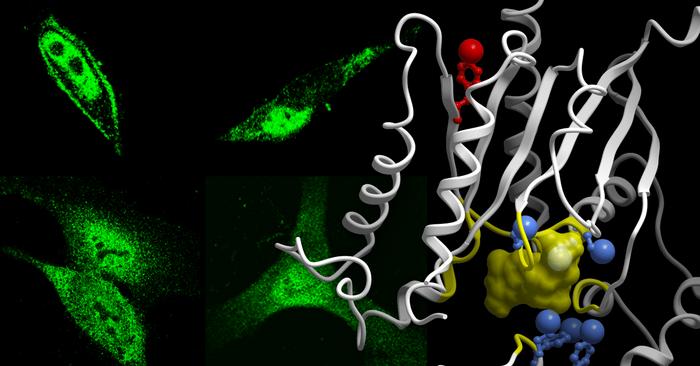
Ghosh zei dat het conflict voortkomt uit problematische fosforylering, de aanhechting van een fosfaatgroep aan het G-eiwitmolecuul. Ze legde uit dat het team geavanceerde massaspectrometrietechnieken gebruikte om alle voorkomens van fosfo-evenementen in kaart te brengen, de plaatsen op G-eiwitten die gefosforyleerd waren toen cellen werden gestimuleerd door groeifactoren. Daarna controleerden ze hoe dit het vermogen van G-eiwitten om hun normale taak stroomafwaarts van GPCR's te vervullen, veranderde.
'Welk aspect van GPCR-signalering we ook bekeken, het werd negatief beïnvloed door bijna alle fosfo-evenementen op het 'schakelaar'-eiwit, het G-eiwit, dat zou worden geïntroduceerd door groeifactoren', zei Kufareva. 'Dat was begrijpelijk toen we keken hoe deze fosfo-evenementen de G-eiwitstructuur vervormden. Groeifactoren 'stelen' effectief G-eiwitten van GPCR's en verlammen op deze manier hun signalering.'
Verder testen van de fosfo-evenementen toonden aan dat één enkel aminozuur verantwoordelijk was voor de diefstal van het G-eiwit. Ghosh zei dat het aminozuur dat bekend staat als tyrosine zich op positie 320 bevindt in het G-eiwit, wat toevallig aan de zijde van het G-eiwit is dat contact maakt met G-eiwitgekoppelde receptoren.
'Deze specifieke tyrosine werd bijna een decennium geleden geïdentificeerd als een speciaal 'triggerpunt' voor G-eiwitgekoppelde receptoren om hun signalen door te geven. We begonnen na te denken over het belang van zo'n toeval', legde Ghosh uit. 'Toen ging er een lampje branden in ons hoofd: Als celcommunicatie een spel zou zijn, zou de tyrosine op positie 320 op het G-eiwit de zoemer zijn. Als de groeifactoren er het eerst bij waren en die site fosforyleerden, hadden de G-eiwitgekoppelde receptoren simpelweg geen kans.'
Kufareva en Ghosh zeggen dat de ontdekking van de groep gevolgen heeft voor de ontwikkeling van nieuwe therapieën voor een aantal aandoeningen, waaronder kanker. Ghosh zei dat veel geneesmiddelen op de markt effectief zijn bij de behandeling van een breed scala aan ziekten omdat de geneesmiddelen zich richten op G-eiwitgekoppelde receptoren. Maar er blijven een aantal aandoeningen zonder goede medicamenteuze therapieën - fibrose, chronische ontstekingen en kankers - omdat tot nu toe de interactie van deze twee paden niet is begrepen.
'We geloven dat onze bevindingen waarschijnlijk zowel belangrijk als actueel zullen zijn, en zullen bijdragen aan andere opkomende studies die het landschap in kaart brengen van deze twee belangrijke signaalwegen die vrijwel elk proces in onze cellen beheersen', zei Ghosh.
'Our work is especially relevant in that growth factors, their receptors, and G-protein-coupled receptors appear to be highly co-expressed in many cancers,' added Kufareva.
All authors on the paper are associated with UC San Diego. Suchismita Roy, Saptarshi Sinha and Ananta James Silas are members of the School of Medicine's Department of Cellular and Molecular Medicine, while Majid Ghassemian is a member of the Department of Chemistry and Biochemistry, Biomolecular and Proteomics Mass Spectrometry Facility.
Journal information: Science Signaling
Provided by University of California - San Diego




