La poursuite d'un 'court-circuit' cellulaire éclaire sur la manière dont certaines maladies commencent
4 juin 2024
Cet article a été révisé conformément au processus éditorial et aux politiques de Science X. Les éditeurs ont souligné les attributs suivants tout en assurant la crédibilité du contenu :
- vérifié les faits
- publication évaluée par des pairs
- source de confiance
- relu
par l'Université de Californie - San Diego
Un groupe de chercheurs de l'Université de Californie à San Diego a identifié la cause d'un 'court-circuit' dans les voies cellulaires, une découverte qui jette une nouvelle lumière sur la genèse de plusieurs maladies humaines.
L'étude récente, publiée dans la revue Science Signaling, explore le mécanisme biochimique qui peut interrompre la chaîne de communication cellulaire - une interaction perturbatrice que Pradipta Ghosh, M.D., compare à un 'buzzer' qui met fin à la partie.
Ghosh, professeur aux départements de médecine et de médecine cellulaire et moléculaire à l'école de médecine de l'Université de Californie à San Diego, et Irina Kufareva, Ph.D., professeur associé à l'école de pharmacie et de sciences pharmaceutiques Skaggs de l'Université de Californie à San Diego, sont les auteurs correspondants de l'article.
L'article explique le mécanisme de 'communication croisée' entre deux voies cellulaires, l'une initiée par des protéines appelées facteurs de croissance et l'autre par leurs récepteurs cellulaires. La deuxième voie est médiée par un ensemble totalement différent de récepteurs cellulaires couplés aux protéines G (GPCRs). Les deux classes de récepteurs délivrent des messages moléculaires de l'extérieur vers l'intérieur de la cellule et signalent aux cellules de changer d'une manière ou d'une autre. Kufareva dit que les membres de la famille des GPCR sont la cible d'environ 34% de tous les médicaments approuvés par la Food and Drug Administration des États-Unis.
'Les GPCRs sont des cibles de médicaments importantes principalement en raison de leur implication dans des voies de signalisation liées à de nombreuses maladies', a-t-elle expliqué, citant les troubles mentaux et endocrinologiques, les infections virales, les conditions cardiovasculaires et inflammatoires, et même le cancer.
Les facteurs de croissance permettent une deuxième voie de communication tout aussi importante à l'intérieur de la cellule qui fait croître et diviser les cellules. Alors que les GPCRs agissent par des commutateurs moléculaires intracellulaires (protéines G), on pense généralement que les récepteurs des facteurs de croissance contournent les commutateurs. Cependant, Ghosh et Kufareva notent que les chercheurs ont eu des soupçons sur une sorte de conflit potentiel entre les deux voies, et des recherches minutieuses ont permis à l'équipe de l'UC San Diego de l'identifier.
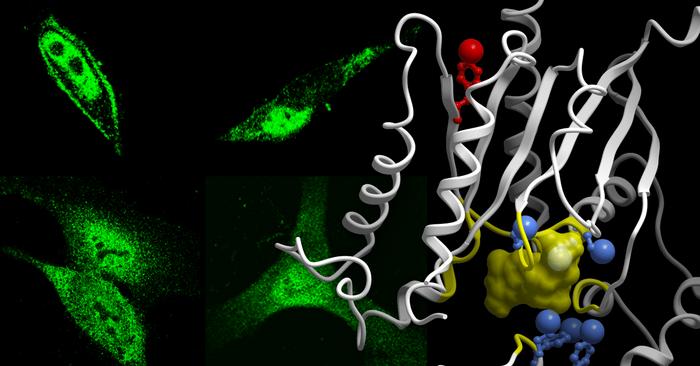
Ghosh a dit que le conflit provient de la phosphorylation problématique, l'attachement d'un groupe phosphate à la molécule de protéine G. Elle a expliqué que l'équipe a utilisé des techniques de spectrométrie de masse avancées pour cartographier toutes les occurrences de phosphoévénements, les sites sur les protéines G qui étaient phosphorylés lorsque les cellules étaient stimulées par des facteurs de croissance. Ils ont ensuite vérifié comment cela changeait la capacité des protéines G à effectuer leur travail normal en aval des GPCRs.
'Quel que soit l'aspect de la signalisation des GPCR que nous avons examiné, il a été négativement impacté par presque tous les phosphoévénements sur la protéine de 'commutation' - la protéine G - qui serait introduite par les facteurs de croissance', a déclaré Kufareva. 'C'était compréhensible lorsque nous avons examiné comment ces phosphoévénements déformaient la structure de la protéine G. Les facteurs de croissance 'volent' efficacement les protéines G aux GPCR et paralysent ainsi leur signalisation.'
De plus, les tests des phosphoévénements ont montré qu'un seul acide aminé était responsable du vol de la protéine G. Ghosh a dit que l'acide aminé connu sous le nom de tyrosine se situe à la position 320 à l'intérieur de la protéine G, qui se trouve sur le côté de la protéine G qui entre en contact avec les récepteurs couplés aux protéines G.
'Cette tyrosine spécifique a été identifiée il y a près d'une décennie comme un 'point de déclenchement' spécial pour les récepteurs couplés aux protéines G pour relayer leurs signaux. Nous avons commencé à réfléchir à l'importance d'une telle coïncidence', a expliqué Ghosh. 'C'est alors qu'une idée nous est venue : si la communication cellulaire était un jeu, la tyrosine à la position 320 sur la protéine G serait le buzzer. Si les facteurs de croissance s'en emparaient d'abord et phosphorylaient ce site, les récepteurs couplés aux protéines G n'avaient tout simplement aucune chance.'
Kufareva et Ghosh disent que la découverte du groupe a des implications pour le développement de nouvelles thérapies pour un certain nombre de conditions, y compris le cancer. Ghosh a dit que de nombreux médicaments sur le marché sont efficaces pour traiter un large éventail de maladies parce que les médicaments ciblent les récepteurs couplés aux protéines G. Mais il reste un certain nombre de conditions sans bonnes thérapies médicamenteuses - fibrose, inflammation chronique et cancers - car jusqu'à présent, l'interaction de ces deux voies n'a pas été comprise.
'Nous croyons que nos découvertes sont susceptibles d'être à la fois importantes et opportunes, et contribueront à d'autres études émergentes cartographiant le paysage de ces deux principales voies de signalisation qui contrôlent pratiquement tous les processus dans nos cellules', a déclaré Ghosh.
'Our work is especially relevant in that growth factors, their receptors, and G-protein-coupled receptors appear to be highly co-expressed in many cancers,' added Kufareva.
All authors on the paper are associated with UC San Diego. Suchismita Roy, Saptarshi Sinha and Ananta James Silas are members of the School of Medicine's Department of Cellular and Molecular Medicine, while Majid Ghassemian is a member of the Department of Chemistry and Biochemistry, Biomolecular and Proteomics Mass Spectrometry Facility.
Journal information: Science Signaling
Provided by University of California - San Diego




