Estudio examina cómo se repara el daño del ADN por enzimas antioxidantes
1 de junio de 2023
Este artículo ha sido revisado de acuerdo con el proceso editorial y las políticas de Science X. Los editores han destacado los siguientes atributos mientras garantizan la credibilidad del contenido:
- verificación de hechos
- publicación revisada por pares
- corrección de pruebas
por el Centro de Regulación Genómica
Una célula humana típica es metabólicamente activa, rugiendo con reacciones químicas que convierten los nutrientes en energía y productos útiles que sostienen la vida. Estas reacciones también crean especies reactivas de oxígeno, productos peligrosos como el peróxido de hidrógeno que dañan los bloques de construcción del ADN de la misma manera que el oxígeno y el agua corroen el metal y forman óxido. De manera similar a como los edificios colapsan por el efecto acumulativo del óxido, las especies reactivas de oxígeno amenazan la integridad del genoma.
Se cree que las células equilibran delicadamente sus necesidades de energía y evitan dañar el ADN conteniendo la actividad metabólica fuera del núcleo y dentro del citoplasma y las mitocondrias. Las enzimas antioxidantes se despliegan para eliminar las especies reactivas de oxígeno en su origen antes de que alcancen el ADN, una estrategia defensiva que protege los aproximadamente 3 mil millones de nucleótidos de sufrir mutaciones potencialmente catastróficas. Si ocurre daño al ADN de todos modos, las células se detienen momentáneamente y llevan a cabo reparaciones, sintetizando nuevos bloques de construcción y llenando los espacios.
A pesar del papel central del metabolismo celular en el mantenimiento de la integridad del genoma, no ha habido ningún estudio sistemático e imparcial sobre cómo las perturbaciones metabólicas afectan el proceso de daño y reparación del ADN. Esto es particularmente importante para enfermedades como el cáncer, caracterizado por su capacidad para secuestrar los procesos metabólicos para un crecimiento sin restricciones.
Un equipo de investigación liderado por Sara Sdelci en el Centro de Regulación Genómica (CRG) de Barcelona y Joanna Loizou en el CeMM Research Center for Molecular Medicine de la Academia de Ciencias de Austria en Viena y la Universidad Médica de Viena ha abordado este desafío llevando a cabo varios experimentos para identificar qué enzimas y procesos metabólicos son esenciales para la respuesta del daño al ADN de una célula. Los hallazgos se publican hoy en la revista Molecular Systems Biology.
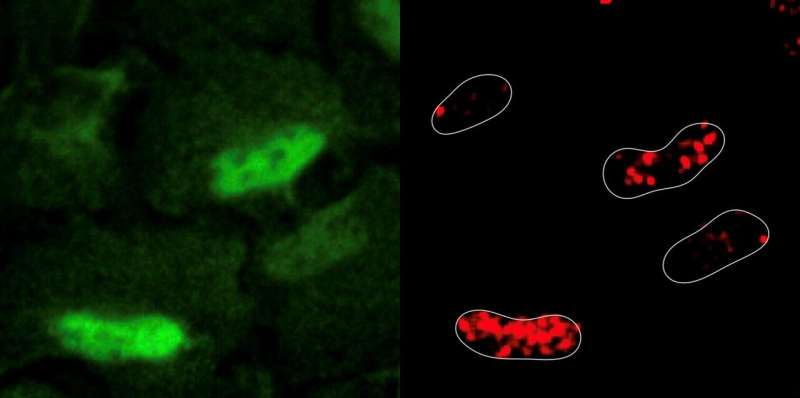
Los investigadores indujeron experimentalmente daño al ADN en líneas celulares humanas utilizando un medicamento de quimioterapia conocido como etopósido. El etopósido funciona rompiendo las cadenas de ADN y bloqueando una enzima que ayuda a reparar el daño. Sorprendentemente, la inducción de daño al ADN dio lugar a la generación y acumulación de especies reactivas de oxígeno dentro del núcleo. Los investigadores observaron que las enzimas respiratorias celulares, una fuente importante de especies reactivas de oxígeno, se desplazaron de las mitocondrias al núcleo en respuesta al daño del ADN.
Los hallazgos representan un cambio de paradigma en la biología celular porque sugieren que el núcleo es metabólicamente activo. 'Donde hay humo hay fuego, y donde hay especies reactivas de oxígeno hay enzimas metabólicas en acción. Históricamente, hemos pensado en el núcleo como un orgánulo metabólicamente inerte que importa todas sus necesidades del citoplasma, pero nuestro estudio demuestra que otro tipo de metabolismo existe en las células y se encuentra en el núcleo', dice la Dra. Sdelci, autora correspondiente del estudio y líder de grupo en el Centro de Regulación Genómica.
Los investigadores también utilizaron CRISPR-Cas9 para identificar todos los genes metabólicos que eran importantes para la supervivencia celular en este escenario. Estos experimentos revelaron que las células ordenan a la enzima PRDX1, una enzima antioxidante normalmente también encontrada en las mitocondrias, que viaje al núcleo y recoge las especies reactivas de oxígeno presentes para evitar más daño. También se descubrió que PRDX1 repara el daño regulando la disponibilidad celular de ácido aspártico, una materia prima que es crítica para sintetizar nucleótidos, los bloques de construcción del ADN.
'PRDX1 es como un limpiafondos robótico para piscinas. Se sabe que las células lo usan para mantener su interior 'limpio' y evitar la acumulación de especies reactivas de oxígeno, pero nunca antes a nivel nuclear. Esto es evidencia de que, en un estado de crisis, el núcleo responde apropiándose de la maquinaria mitocondrial y establece una política de rápida industrialización de emergencia', dice la Dra. Sdelci.
Los hallazgos pueden guiar futuras líneas de investigación sobre el cáncer. Algunos medicamentos contra el cáncer, como el etopósido utilizado en este estudio, matan las células tumorales dañando su ADN e inhibiendo el proceso de reparación. Si se acumula suficiente daño, la célula cancerosa inicia un proceso en el que se autodestruye.
During their experiments, the researchers found that knocking out metabolic genes critical for cellular respiration—the process that generates energy from oxygen and nutrients—made normal healthy cells become resistant to etoposide. The finding is important because many cancer cells are glycolytic, meaning that even in the presence of oxygen they generate energy without doing cellular respiration. This means etoposide, and other chemotherapies with a similar mechanism, is likely to have a limited effect in treating glycolytic tumors.
The authors of the study call for the exploration of new strategies such as dual treatment combining etoposide with drugs that also boost the generation of reactive oxygen species to overcome drug resistance and kill cancer cells faster. They also hypothesize that combining etoposide with inhibitors of nucleotide synthesis processes could potentiate the effect of the drug by preventing the repair of DNA damage and ensuring cancer cells self-destruct correctly.
Dr. Loizou, corresponding author and Group Leader at the Centre for Molecular Medicine and the Medical University of Vienna, highlights the value of taking data-driven approaches to uncover new biological processes. 'By using unbiased technologies such as CRISPR-Cas9 screening and metabolomics, we have learnt about how the two fundamental cellular processes of DNA repair and metabolism are intertwined. Our findings shed light on how targeting these two pathways in cancer might improve therapeutic outcomes for patients.'
Journal information: Molecular Systems Biology
Provided by Center for Genomic Regulation




