Étude examine comment les dommages de l'ADN sont réparés par des enzymes antioxydantes.
1er juin 2023
Cet article a été examiné selon le processus éditorial et les politiques de Science X. Les éditeurs ont mis en évidence les attributs suivants tout en assurant la crédibilité du contenu :
- vérifié par des faits
- publication examinée par des pairs
- corrige
par Centre de régulation génomique
Une cellule humaine typique est métaboliquement active, rugissante avec des réactions chimiques qui convertissent les nutriments en énergie et en produits utiles qui soutiennent la vie. Ces réactions créent également des espèces réactives de l'oxygène, des sous-produits dangereux comme le peroxyde d'hydrogène qui endommagent les blocs de construction de l'ADN de la même manière que l'oxygène et l'eau corrode le métal et forme de la rouille. Comme les bâtiments qui s'effondrent sous l'effet cumulatif de la rouille, les espèces réactives de l'oxygène menacent l'intégrité du génome.
On pense que les cellules équilibrent délicatement leurs besoins énergétiques et évitent d'endommager l'ADN en contenant l'activité métabolique à l'extérieur du noyau et à l'intérieur du cytoplasme et des mitochondries. Des enzymes antioxydantes sont déployées pour nettoyer les espèces réactives de l'oxygène à leur source avant qu'elles n'atteignent l'ADN, une stratégie défensive qui protège les quelque 3 milliards de nucléotides de mutations potentiellement catastrophiques. Si des dommages à l'ADN se produisent malgré tout, les cellules s'arrêtent brièvement et effectuent des réparations, synthétisant de nouveaux blocs de construction et remplissant les lacunes.
Malgré le rôle central du métabolisme cellulaire dans le maintien de l'intégrité du génome, il n'y a pas eu d'étude systématique et impartiale sur la façon dont les perturbations métaboliques affectent le processus de dommages et de réparation de l'ADN. Ceci est particulièrement important pour des maladies comme le cancer, caractérisées par leur capacité à s'emparer des processus métaboliques pour une croissance sans entraves.
Une équipe de recherche dirigée par Sara Sdelci au Centre de régulation génomique (CRG) à Barcelone et Joanna Loizou au Centre de recherche CeMM pour la médecine moléculaire de l'Académie autrichienne des sciences de Vienne et l'Université médicale de Vienne a relevé ce défi en effectuant diverses expériences pour identifier quelles enzymes et processus métaboliques sont essentiels pour la réponse aux dommages de l'ADN d'une cellule. Les résultats sont publiés aujourd'hui dans la revue Molecular Systems Biology.
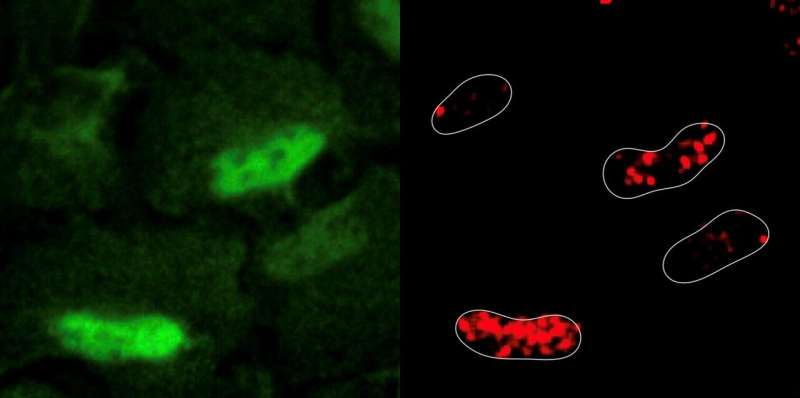
Les chercheurs ont induit expérimentalement des dommages à l'ADN dans des lignées cellulaires humaines en utilisant un médicament de chimiothérapie courant appelé étoposide. L'étoposide fonctionne en cassant les brins d'ADN et en bloquant une enzyme qui aide à réparer les dommages. Étonnamment, l'induction de dommages à l'ADN a entraîné la génération et l'accumulation d'espèces réactives de l'oxygène à l'intérieur du noyau. Les chercheurs ont observé que les enzymes respiratoires cellulaires, une source majeure d'espèces réactives de l'oxygène, ont été déplacées des mitochondries vers le noyau en réponse aux dommages de l'ADN.
Les résultats représentent un changement de paradigme en biologie cellulaire car ils suggèrent que le noyau est métaboliquement actif. « Où il y a de la fumée, il y a du feu, et où il y a des espèces réactives de l'oxygène, il y a des enzymes métaboliques qui travaillent. Historiquement, nous avons considéré le noyau comme un organe métaboliquement inerte qui importe tous ses besoins depuis le cytoplasme, mais notre étude démontre qu'un autre type de métabolisme existe dans les cellules et se trouve dans le noyau », dit le Dr Sdelci, auteur correspondant de l'étude et chef de groupe au Centre de régulation génomique.
Les chercheurs ont également utilisé CRISPR-Cas9 pour identifier tous les gènes métaboliques importants pour la survie cellulaire dans ce scénario. Ces expériences ont révélé que les cellules ordonnent à l'enzyme PRDX1, une enzyme antioxydante également normalement trouvée dans les mitochondries, de se déplacer dans le noyau et de récupérer les espèces réactives de l'oxygène présentes pour éviter des dommages supplémentaires. PRDX1 a également été trouvé pour réparer les dommages en régulant la disponibilité cellulaire d'aspartate, une matière première qui est cruciale pour la synthèse de nucléotides, les blocs de construction de l'ADN.
« PRDX1 est comme un nettoyeur de piscine robotique. On sait que les cellules l'utilisent pour garder leur intérieur 'propre' et éviter l'accumulation d'espèces réactives de l'oxygène, mais jamais auparavant au niveau nucléaire. C'est une preuve que dans un état de crise, le noyau répond en s'appropriant la machinerie mitochondriale et en établissant une politique d'industrialisation d'urgence rapide », dit le Dr Sdelci.
Les résultats peuvent guider les futures lignes de recherche sur le cancer. Certains médicaments anticancéreux, tels que l'étoposide utilisé dans cette étude, tuent les cellules tumorales en endommageant leur ADN et en inhibant le processus de réparation. Si suffisamment de dommages s'accumulent, la cellule cancéreuse lance un processus où elle s'autodétruit.
During their experiments, the researchers found that knocking out metabolic genes critical for cellular respiration—the process that generates energy from oxygen and nutrients—made normal healthy cells become resistant to etoposide. The finding is important because many cancer cells are glycolytic, meaning that even in the presence of oxygen they generate energy without doing cellular respiration. This means etoposide, and other chemotherapies with a similar mechanism, is likely to have a limited effect in treating glycolytic tumors.
The authors of the study call for the exploration of new strategies such as dual treatment combining etoposide with drugs that also boost the generation of reactive oxygen species to overcome drug resistance and kill cancer cells faster. They also hypothesize that combining etoposide with inhibitors of nucleotide synthesis processes could potentiate the effect of the drug by preventing the repair of DNA damage and ensuring cancer cells self-destruct correctly.
Dr. Loizou, corresponding author and Group Leader at the Centre for Molecular Medicine and the Medical University of Vienna, highlights the value of taking data-driven approaches to uncover new biological processes. 'By using unbiased technologies such as CRISPR-Cas9 screening and metabolomics, we have learnt about how the two fundamental cellular processes of DNA repair and metabolism are intertwined. Our findings shed light on how targeting these two pathways in cancer might improve therapeutic outcomes for patients.'
Journal information: Molecular Systems Biology
Provided by Center for Genomic Regulation




