Studie untersucht, wie DNA-Schäden von Antioxidans-Enzymen repariert werden.
1. Juni 2023
Dieser Artikel wurde gemäß dem redaktionellen Prozess und den Richtlinien von Science X überprüft. Die Herausgeber haben die folgenden Attribute hervorgehoben und dabei die Glaubwürdigkeit des Inhalts sichergestellt:
- Fakten geprüft
- Von Fachkollegen begutachtete Veröffentlichung
- Korrigiert
Vom Center for Genomic Regulation erstellt
Eine typische menschliche Zelle ist metabolisch aktiv und voller chemischer Reaktionen, die Nährstoffe in Energie und nützliche Produkte umwandeln, die das Leben aufrechterhalten. Diese Reaktionen erzeugen auch reaktive Sauerstoffspezies und gefährliche Nebenprodukte wie Wasserstoffperoxid, die die Bausteine der DNA auf die gleiche Weise beschädigen wie Sauerstoff und Wasser Metall korrodieren und Rost bilden. Ähnlich wie Gebäude durch den kumulativen Effekt von Rost zusammenbrechen, bedrohen reaktive Sauerstoffspezies die Integrität des Genoms.
Zellen sollen ihre Energiebedürfnisse empfindlich ausbalancieren und DNA-Schäden vermeiden, indem sie Stoffwechselaktivitäten außerhalb des Zellkerns und innerhalb des Zytoplasmas und der Mitochondrien eindämmen. Antioxidative Enzyme werden eingesetzt, um reaktive Sauerstoffspezies an ihrer Quelle einzufangen, bevor sie die DNA erreichen, eine defensive Strategie, die die ungefähr 3 Milliarden Nukleotide vor potenziell katastrophalen Mutationen schützt. Wenn es dennoch zu DNA-Schäden kommt, halten Zellen kurzzeitig inne und führen Reparaturen durch, indem sie neue Bausteine synthetisieren und die Lücken schließen.
Trotz der zentralen Rolle des zellulären Stoffwechsels bei der Aufrechterhaltung der Genomintegrität gab es keine systematische, unvoreingenommene Studie darüber, wie Stoffwechselstörungen den DNA-Schaden- und Reparaturprozess beeinflussen. Dies ist besonders wichtig für Krankheiten wie Krebs, die sich durch ihre Fähigkeit auszeichnen, Stoffwechselvorgänge für unkontrolliertes Wachstum zu nutzen.
Ein Forschungsteam unter der Leitung von Sara Sdelci am Centre for Genomic Regulation (CRG) in Barcelona und Joanna Loizou am CeMM Research Center for Molecular Medicine der Österreichischen Akademie der Wissenschaften in Wien und der Medizinischen Universität Wien hat diese Herausforderung durchgeführt eine Reihe von Experimenten durchgeführt, um zu identifizieren, welche metabolischen Enzyme und Prozesse für die DNA-Schadensantwort einer Zelle unerlässlich sind. Die Ergebnisse werden heute in der Fachzeitschrift Molecular Systems Biology veröffentlicht.
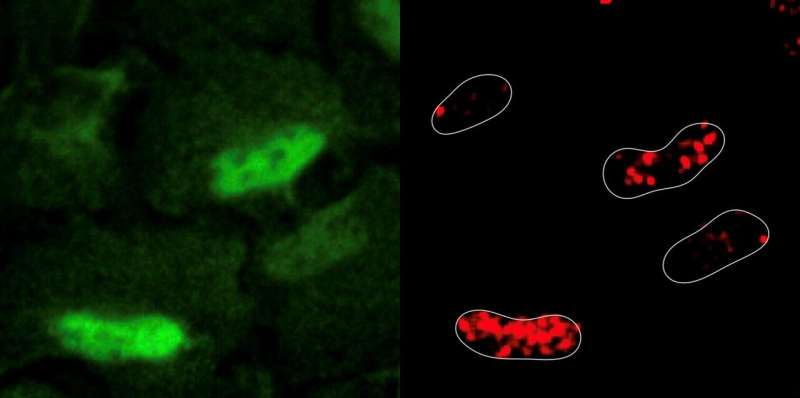
Die Forscher induzierten experimentell DNA-Schäden in menschlichen Zelllinien mit einem häufig verwendeten Chemotherapeutikum namens Etoposid. Etoposid wirkt, indem es DNA-Stränge bricht und ein Enzym blockiert, das die Reparatur des Schadens unterstützt. Überraschenderweise führte die Induktion von DNA-Schäden dazu, dass reaktive Sauerstoffspezies im Zellkern erzeugt und angesammelt wurden. Die Forscher stellten fest, dass zelluläre Atmungsenzyme, eine wichtige Quelle für reaktive Sauerstoffspezies, in Reaktion auf die DNA-Schädigung vom Mitochondrium in den Zellkern umziehen.
Die Ergebnisse stellen eine Paradigmenverschiebung in der zellulären Biologie dar, da sie darauf hindeuten, dass der Zellkern metabolisch aktiv ist. 'Wo Rauch ist, ist auch Feuer, und wo reaktive Sauerstoffspezies sind, sind metabolische Enzyme am Werk. Historisch haben wir den Zellkern als metabolisch träge Organellen betrachtet, die alle ihre Bedürfnisse aus dem Zytoplasma importieren, aber unsere Studie zeigt, dass in Zellen eine andere Art von Stoffwechsel existiert und im Kern gefunden wird', sagt Dr. Sdelci, entsprechende Autorin der Studie und Gruppenleiterin am Centre for Genomic Regulation.
Die Forscher verwendeten auch CRISPR-Cas9, um alle metabolischen Gene zu identifizieren, die in diesem Szenario für das Überleben der Zelle wichtig waren. Diese Experimente enthüllten, dass Zellen das Enzym PRDX1, ein Antioxidans-Enzym, das normalerweise auch in Mitochondrien zu finden ist, anordnen, um in den Zellkern zu gelangen und die dort vorhandenen reaktiven Sauerstoffspezies zu beseitigen, um weitere Schäden zu verhindern. PRDX1 wurde auch gefunden, um den Schaden zu reparieren, indem es die zelluläre Verfügbarkeit von Aspartat reguliert, einem Rohmaterial, das für die Synthese von Nukleotiden, den Bausteinen der DNA, entscheidend ist.
''PRDX1 ist wie ein robotischer Poolreiniger. Es ist bekannt, dass Zellen es verwenden, um ihr Inneres 'sauber' zu halten und die Ansammlung von reaktiven Sauerstoffspezies zu verhindern, aber niemals zuvor auf nukleare Ebene. Dies ist ein Beweis dafür, dass der Zellkern bei einem Krisenzustand reagiert, indem er Mitochondrien-Maschinen aneignet und eine Notfall-Rapid-Industrialisierungspolitik etabliert', sagt Dr. Sdelci.
Die Ergebnisse können zukünftige Krebsforschungsprogramme leiten. Einige Krebsmedikamente, wie das in dieser Studie verwendete Etoposid, töten Tumorzellen, indem sie ihre DNA schädigen und den Reparaturprozess hemmen. Wenn sich genügend Schäden ansammeln, initiiert die Krebszelle einen Prozess, bei dem sie sich selbst zerstört.
During their experiments, the researchers found that knocking out metabolic genes critical for cellular respiration—the process that generates energy from oxygen and nutrients—made normal healthy cells become resistant to etoposide. The finding is important because many cancer cells are glycolytic, meaning that even in the presence of oxygen they generate energy without doing cellular respiration. This means etoposide, and other chemotherapies with a similar mechanism, is likely to have a limited effect in treating glycolytic tumors.
The authors of the study call for the exploration of new strategies such as dual treatment combining etoposide with drugs that also boost the generation of reactive oxygen species to overcome drug resistance and kill cancer cells faster. They also hypothesize that combining etoposide with inhibitors of nucleotide synthesis processes could potentiate the effect of the drug by preventing the repair of DNA damage and ensuring cancer cells self-destruct correctly.
Dr. Loizou, corresponding author and Group Leader at the Centre for Molecular Medicine and the Medical University of Vienna, highlights the value of taking data-driven approaches to uncover new biological processes. 'By using unbiased technologies such as CRISPR-Cas9 screening and metabolomics, we have learnt about how the two fundamental cellular processes of DNA repair and metabolism are intertwined. Our findings shed light on how targeting these two pathways in cancer might improve therapeutic outcomes for patients.'
Journal information: Molecular Systems Biology
Provided by Center for Genomic Regulation




