La posición espacial de la enzima ayuda a las células asesinas naturales a distinguir entre células sanas y enfermas marcadas para la muerte.
24 de julio de 2023
característica
Este artículo ha sido revisado según el proceso editorial y las políticas de Science X. Los editores han destacado los siguientes atributos mientras aseguran la credibilidad del contenido:
- verificado
- publicación revisada por pares
- fuente confiable
- corregido
por Delthia Ricks, Medical Xpress
Surge una serie de preguntas cuando se trata de los mecanismos moleculares desplegados por el sistema inmunológico humano para combatir el cáncer y las infecciones, y especialmente cuando se trata de los pasos precisos tomados por la respuesta inmunológica innata, el primer frenesí de actividad cuando ocurre una enfermedad invasiva.
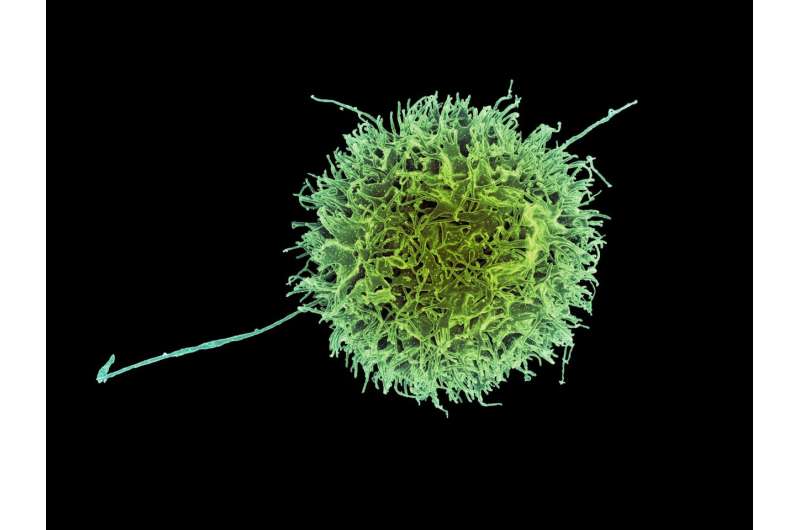
Ahora, los científicos han investigado a fondo la actividad de las células asesinas naturales, componentes clave del sistema inmunológico innato y los primeros en responder en la escena cuando las células cancerosas o los patógenos comprometen los tejidos sanos. El sistema inmunológico innato no solo es la primera línea de defensa del cuerpo, sino que también está presente desde el nacimiento. Y debido a que siempre responde con la misma fuerza relativa independientemente de la anormalidad, a veces se le llama sistema inmunológico no específico.
Un equipo internacional de científicos, liderado por investigadores del Karolinska Institutet en Suecia, ha descubierto que la distribución espacial de una enzima dentro de las células asesinas naturales es fundamental para sus funciones. De hecho, los hallazgos de este lejano equipo de científicos, ubicado en Suecia, Suiza y Japón, sugieren que la posición espacial de la enzima, llamada SHP-1, es crucial para que las células asesinas naturales puedan distinguir entre células comprometidas por enfermedades y las que están sanas e ilesas por infecciones o malignidades.
"Las células asesinas naturales reconocen células infectadas por virus y células tumorales", escriben el Dr. Laurent Schmied y sus colegas en la revista Science Signaling. "La función de las células asesinas naturales depende de señalización equilibrada de receptores activadores, que reconocen productos de tumores o virus, y receptores inhibitorios, que reconocen moléculas del complejo principal de histocompatibilidad clase I; MHC-I".
Aunque las células asesinas naturales pueden formar parte del sistema inmunológico no específico, poseen un alto grado de especificidad cuando se trata de reconocer y eliminar células infectadas por virus o comprometidas por el cáncer.
Según Schmied y colaboradores, lo hacen formando contactos llamados sinapsis con células comprometidas y liberando enzimas para destruir estos objetivos enfermos. El proceso por el cual las células asesinas naturales adquieren la capacidad de distinguir entre células normales -propias- y las anormales o infectadas se conoce como "educación", y la evitación de matar células normales se denomina "tolerancia propia".
Al comprender mejor cómo las células asesinas naturales llevan a cabo su trabajo de eliminar sus objetivos comprometidos, los científicos obtienen una visión más precisa del papel de un tipo de glóbulo blanco, formalmente llamado linfocito granular grande.
El sistema innato difiere del sistema inmunitario adaptativo, también llamado adquirido, que está compuesto por los linfocitos altamente especializados conocidos como células B y células T. El sistema inmunitario adaptativo se adquiere gradualmente y tiene memoria, la capacidad de recordar a un invasor que haya infiltrado el cuerpo en el pasado.
Las células B y las células T son conocidas por su especificidad, y las células B son productoras de anticuerpos que combaten enfermedades. En cambio, las células asesinas naturales utilizan una fuerza bruta para eliminar la enfermedad del cuerpo, pero esa fuerza se basa en mecanismos moleculares demostradamente sofisticados para lograr el objetivo.
"Descubrimos que la tolerancia y educación de las células asesinas naturales se determinaron por la localización subcelular de la fosfatasa de tirosina, SHP-1", señaló Schmied, médico científico en el departamento de hematología y medicina regenerativa en el Karolinska Institutet. Como autor principal de un artículo titulado "La localización de SHP-1 en la sinapsis inmunológica activadora promueve la tolerancia de NK en la deficiencia de clase I del MHC", Schmied enfatizó que "la ubicación es importante para las células asesinas".
Usando modelos animales, Schmied y sus colegas compararon células no educadas y educadas y descubrieron que la educación alteraba la ubicación de SHP-1. La investigación con modelos animales también demostró que durante la educación, los receptores inhibitorios secuestraban SHP-1. Este hallazgo reveló cómo SHP-1 facilita la eliminación de las células objetivo.
"En ratones que carecen de moléculas MHC-I, las células asesinas naturales no educadas y auto tolerantes mostraron acumulación de SHP-1 en la sinapsis inmunológica activadora, donde se co-localizó con F-actina y la proteína adaptadora de señalización", escribió Schmied.
During NK cell education, signaling through inhibitory receptors ensures that natural killer cells both tolerate normal cells and respond to molecules on cells that should be destroyed. Natural killer cell activation depends on the balance in signaling between activating receptors, which recognize proteins that are present on stressed cells, and inhibitory receptors, which recognize protein markers on healthy cells and other determinants of tolerance.
© 2023 Science X Network




