Die räumliche Positionierung des Enzyms hilft natürlichen Killerzellen, gesunde Zellen von erkrankten zu unterscheiden, die zum Tode markiert wurden.
24. Juli 2023 Funktion
Dieser Artikel wurde gemäß dem redaktionellen Prozess und den Richtlinien von Science X überprüft. Die Herausgeber haben die folgenden Merkmale hervorgehoben und dabei die Glaubwürdigkeit des Inhalts sichergestellt:
- Tatsachenüberprüft
- Von Fachleuten begutachtete Veröffentlichung
- Vertrauenswürdige Quelle
- Korrekturgelesen
von Delthia Ricks, Medical Xpress
Fragen tauchen auf, wenn es um die molekularen Mechanismen geht, die vom menschlichen Immunsystem eingesetzt werden, um Krebs und Infektionen zu bekämpfen. Besonders viele Fragen gibt es, wenn es um die genauen Schritte der angeborenen Immunantwort geht, den ersten Schub an Aktivität, der bei einer invasiven Krankheit auftritt.
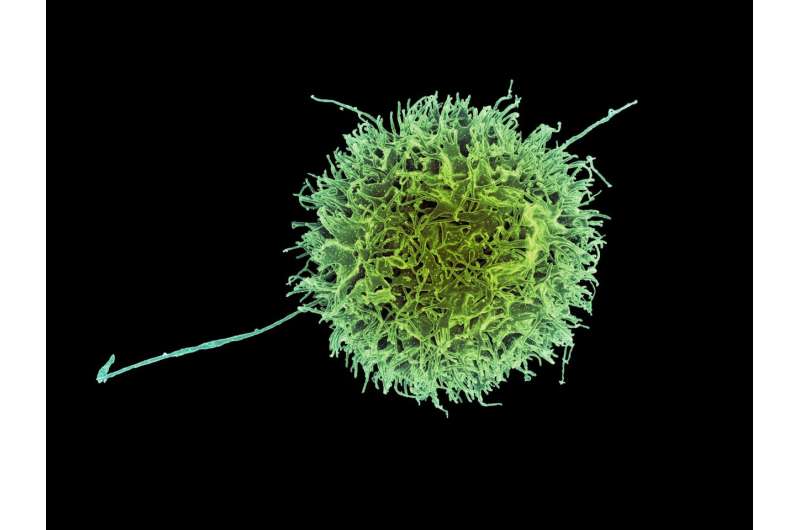
Wissenschaftler haben nun einen tiefen Einblick in die Aktivität sogenannter natürlicher Killerzellen gewonnen, wichtige Bestandteile des angeborenen Immunsystems und erste Helfer vor Ort, wenn Krebszellen oder Krankheitserreger gesundes Gewebe gefährden. Das angeborene Immunsystem ist nicht nur die erste Verteidigungslinie des Körpers, es ist auch von Geburt an vorhanden. Und weil es unabhängig von der Abnormalität immer mit derselben relativen Stärke reagiert, wird es manchmal als unspezifisches Immunsystem bezeichnet.
Ein internationales Forscherteam unter der Leitung von Wissenschaftlern des Karolinska-Instituts in Schweden hat festgestellt, dass die räumliche Verteilung eines Enzyms innerhalb natürlicher Killerzellen für deren Funktionen entscheidend ist. Tatsächlich legen die Ergebnisse dieses weit verstreuten Teams von Wissenschaftlern, die sich in Schweden, der Schweiz und Japan befanden, nahe, dass die räumliche Positionierung des Enzyms, das als SHP-1 bezeichnet wird, entscheidend dafür ist, dass natürliche Killerzellen zwischen Zellen unterscheiden können, die von Krankheit beeinträchtigt sind, und solchen, die gesund sind und von Infektionen oder Malignität unberührt bleiben.
"Natürliche Killerzellen erkennen virusinfizierte Zellen und Tumorzellen", schreiben Dr. Laurent Schmied und Kollegen im Journal Science Signaling. "Die Funktion natürlicher Killerzellen hängt von einer ausbalancierten Signalgebung der aktivierenden Rezeptoren ab, die Produkte von Tumoren oder Viren erkennen, und der inhibierenden Rezeptoren, die MHC-Klasse-I-Moleküle – MHC-I – erkennen."
Auch wenn natürliche Killerzellen Teil des unspezifischen Immunsystems sein können, besitzen sie eine hohe Spezifität, wenn es darum geht, Zellen zu erkennen und abzutöten, die mit Viren infiziert oder durch Krebs beeinträchtigt sind.
Dies tun sie laut Schmied und Mitarbeitern, indem sie Kontakte namens Synapsen mit beeinträchtigten Zellen bilden und Enzyme freisetzen, um diese erkrankten Ziele zu töten. Der Prozess, durch den natürliche Killerzellen die Fähigkeit entwickeln, normale Zellen – Selbst – von abnormen oder infizierten zu unterscheiden, wird als "Ausbildung" bezeichnet. Das Vermeiden der Tötung normaler Zellen wird als "Selbsttoleranz" bezeichnet.
Indem sie ein besseres Verständnis dafür entwickeln, wie natürliche Killerzellen bei der Tötung ihrer gefährdeten Ziele vorgehen, gewinnen Wissenschaftler einen schärferen Einblick in die Rolle einer Art weißer Blutzelle, die formell als großes granulares Lymphozyt bezeichnet wird.
Das angeborene System unterscheidet sich vom adaptiven – auch erworbenen – Immunsystem, das aus den hochspezialisierten Lymphozyten besteht, die als B-Zellen und T-Zellen bekannt sind. Das adaptive Immunsystem wird allmählich erworben und ist mit einer Gedächtnisfunktion ausgestattet – der Fähigkeit, einen Eindringling aus der Vergangenheit, der den Körper infiltriert hat, wiederzuerkennen.
B- und T-Zellen sind für ihre Spezifität bekannt, und B-Zellen produzieren krankheitsbekämpfende Antikörper. Natürliche Killerzellen hingegen setzen rohe Kraft ein, um den Körper von Krankheiten zu befreien, aber diese Stärke basiert auf nachweislich komplexen molekularen Mechanismen, um den Job zu erledigen.
"Wir haben festgestellt, dass die Toleranz und Ausbildung natürlicher Killerzellen durch die subzelluläre Lokalisierung der Tyrosinphosphatase SHP-1 bestimmt wurden", merkte Schmied, ein Arzt-Wissenschaftler in der Abteilung für Hämatologie und regenerative Medizin am Karolinska-Institut, an. Als Hauptautor eines Artikels mit dem Titel "SHP-1-Lokalisierung in der aktiven Immunsynapse fördert die NK-Toleranz bei MHC-Klasse-I-Mangel" betonte Schmied, dass "Standort für Killerzellen wichtig ist".
Unter Verwendung von Tiermodellen verglichen Schmied und Kollegen ungebildete und gebildete Zellen und stellten fest, dass sich die Ausbildung auf den Ort von SHP-1 auswirkte. Die Tiermodellforschung zeigte auch, dass während der Ausbildung inhibierende Rezeptoren SHP-1 binden. Diese Erkenntnis verdeutlichte, wie SHP-1 die Abtötung von Zielzellen erleichtert.
"Bei Mäusen ohne MHC-I-Moleküle wiesen ungebildete, selbsttolerante natürliche Killerzellen eine Anhäufung von SHP-1 in der aktiven Immunsynapse auf, wo es sich mit F-Aktin und dem Signaladapterprotein überlappte", schrieb Schmied.
During NK cell education, signaling through inhibitory receptors ensures that natural killer cells both tolerate normal cells and respond to molecules on cells that should be destroyed. Natural killer cell activation depends on the balance in signaling between activating receptors, which recognize proteins that are present on stressed cells, and inhibitory receptors, which recognize protein markers on healthy cells and other determinants of tolerance.
© 2023 Science X Network




