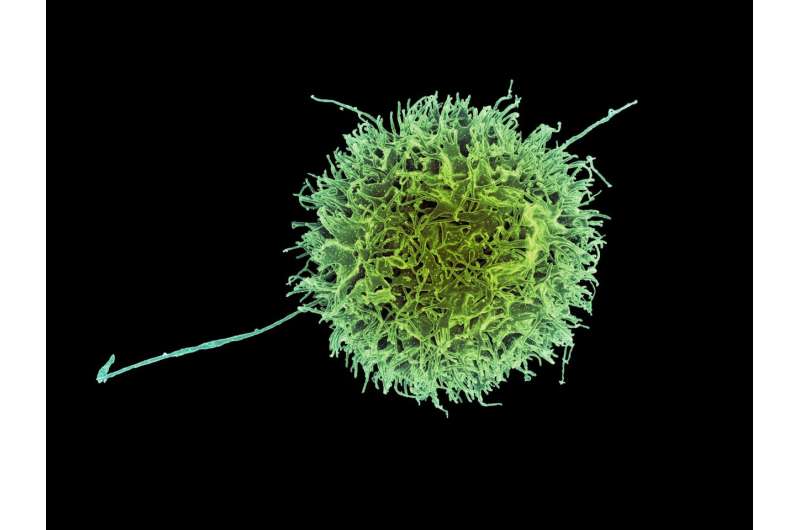
La position spatiale de l'enzyme aide les cellules tueuses naturelles à distinguer les cellules saines des cellules malades condamnées à mourir.
24 juillet 2023
fonctionnalité
Cet article a été examiné selon le processus rédactionnel et les politiques de Science X. Les rédacteurs ont mis en avant les attributs suivants tout en veillant à la crédibilité du contenu :
- vérifié par des faits
- publication évaluée par des pairs
- source de confiance
- relecture effectuée
par Delthia Ricks, Medical Xpress
De nombreuses questions se posent concernant les mécanismes moléculaires déployés par le système immunitaire humain pour contrer le cancer et les infections, et les questions sont particulièrement nombreuses quand il s'agit des étapes précises de la réponse immunitaire innée, le premier afflux d'activité lorsqu'une maladie invasive survient.
Maintenant, des scientifiques se sont plongés dans l'activité des cellules tueuses naturelles, des composantes clés du système immunitaire inné et les premières à intervenir sur le terrain lorsque des cellules cancéreuses ou des agents pathogènes compromettent les tissus sains. Le système immunitaire inné n'est pas seulement la première ligne de défense du corps, il est également présent dès la naissance. Et parce qu'il réagit toujours avec la même force relative indépendamment de l'anomalie, il est parfois appelé le système immunitaire non spécifique.
Une équipe internationale de scientifiques, dirigée par des chercheurs de l'Institut Karolinska en Suède, a découvert que la distribution spatiale d'une enzyme à l'intérieur des cellules tueuses naturelles est cruciale pour ses fonctions. En effet, les résultats de cette équipe dispersée de scientifiques basés en Suède, en Suisse et au Japon, suggèrent que le positionnement spatial de l'enzyme, appelée SHP-1, est crucial pour que les cellules tueuses naturelles puissent distinguer les cellules compromises par la maladie de celles qui sont saines et non affectées par l'infection ou la malignité.
"Les cellules tueuses naturelles reconnaissent les cellules infectées par un virus et les cellules tumorales", écrivent le Dr Laurent Schmied et ses collègues dans la revue Science Signaling. "La fonction des cellules tueuses naturelles dépend d'une signalisation équilibrée des récepteurs activateurs, qui reconnaissent les produits des tumeurs ou des virus, et des récepteurs inhibiteurs, qui reconnaissent les molécules du complexe majeur d'histocompatibilité de classe I (CMHI)".
Bien que les cellules tueuses naturelles fassent partie du système immunitaire non spécifique, elles possèdent un haut degré de spécificité lorsqu'il s'agit de reconnaître et de tuer les cellules infectées par des virus ou compromises par le cancer.
Elles le font, selon Schmied et ses collaborateurs, en établissant des contacts appelés synapses avec les cellules compromises et en libérant des enzymes pour tuer ces cibles malades. Le processus par lequel les cellules tueuses naturelles acquièrent la capacité de distinguer les cellules normales - le soi - des cellules anormales ou infectées est appelé "éducation". L'évitement de la destruction des cellules normales est appelé "tolérance du soi".
En développant une meilleure compréhension de la manière dont les cellules tueuses naturelles accomplissent leur tâche de destruction de leurs cibles compromises, les scientifiques ont une meilleure vision du rôle d'un type de globule blanc, appelé lymphocyte granulaire large.
Le système immunitaire inné diffère du système immunitaire adaptatif, également appelé système immunitaire acquis, qui est composé des lymphocytes hautement spécialisés connus sous le nom de cellules B et de cellules T. Le système immunitaire adaptatif est acquis progressivement et est doté d'une mémoire, c'est-à-dire la capacité de se souvenir d'un envahisseur qui s'est infiltré dans le corps dans le passé.
Les cellules B et T sont connues pour leur spécificité, et les cellules B sont des productrices d'anticorps combattant les maladies. Les cellules tueuses naturelles, en revanche, utilisent une force brute pour éliminer les maladies du corps, mais cette force repose sur des mécanismes moléculaires démontrablement sophistiqués pour accomplir leur tâche.
"Nous avons découvert que la tolérance et l'éducation des cellules tueuses naturelles étaient déterminées par la localisation subcellulaire de la tyrosine phosphatase, la SHP-1", a noté Schmied, médecin-chercheur au département d'hématologie et de médecine régénérative de l'Institut Karolinska. En tant que premier auteur d'un article intitulé "La localisation de la SHP-1 dans la synapse immunitaire active favorise la tolérance des cellules tueuses naturelles en cas de déficit en classe I du CMHI", Schmied a souligné que "la localisation est importante pour les cellules tueuses".
En utilisant des modèles animaux, Schmied et ses collègues ont comparé des cellules non éduquées et éduquées et ont découvert que l'éducation modifiait l'emplacement de la SHP-1. La recherche sur les modèles animaux a également démontré que pendant l'éducation, les récepteurs inhibiteurs séquestraient la SHP-1. Cette découverte a révélé comment la SHP-1 facilite la destruction des cellules cibles.
"Chez les souris dépourvues de molécules du CMHI, les cellules tueuses naturelles non éduquées et tolérantes à elles-mêmes présentaient une accumulation de SHP-1 dans la synapse immunitaire active, où elle co-localisait avec l'actine F et la protéine adaptatrice de signalisation", écrit Schmied.
During NK cell education, signaling through inhibitory receptors ensures that natural killer cells both tolerate normal cells and respond to molecules on cells that should be destroyed. Natural killer cell activation depends on the balance in signaling between activating receptors, which recognize proteins that are present on stressed cells, and inhibitory receptors, which recognize protein markers on healthy cells and other determinants of tolerance.
© 2023 Science X Network




