Des scientifiques cultivent des reins humanisés dans des embryons de porc
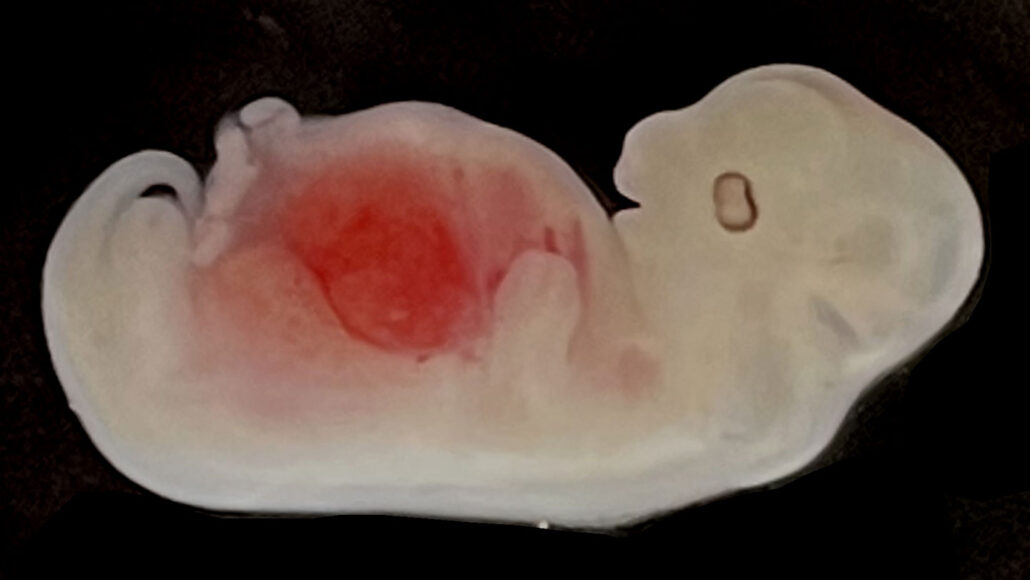
Des scientifiques ont réussi à faire pousser des reins constitués principalement de cellules humaines à l'intérieur d'embryons de porc - ce qui constitue une avancée supplémentaire sur la longue route permettant de produire des organes humains viables pour la transplantation.
Les résultats, rapportés le 7 septembre dans Cell Stem Cell, marquent la première fois qu'un organe solide humanisé, c'est-à-dire contenant à la fois des cellules humaines et animales, a été cultivé à l'intérieur d'une autre espèce.
"C'est un progrès considérable dans la chimère homme-animal", déclare Tao Tan, biologiste cellulaire à l'Université de science et de technologie de Kunming en Chine, qui a participé à la création du premier embryon chimérique homme-singe en 2021 mais n'a pas participé à l'étude actuelle.
Aux États-Unis seulement, plus de 100 000 personnes sont actuellement inscrites sur une liste d'attente pour une transplantation d'organe. La grande majorité de ces personnes ont besoin d'une greffe de rein. Pour répondre à cette demande de greffes d'organes vitales, les scientifiques cherchent de nouvelles méthodes de culture d'organes et de tissus chez les animaux (SN: 1/26/17).
Les avancées réalisées au cours des dernières années incluent la culture d'organes de rat chez la souris (et vice versa) et de tissus musculaires squelettiques et endothéliaux humanisés chez le porc. Cependant, des obstacles significatifs subsistent, en partie en raison de la difficulté pour les cellules humaines de prospérer à l'intérieur d'un hôte étranger. Les cellules souches pluripotentes induites humaines, ou CSPiH, qui agissent comme une sorte de "kit de départ" pour la culture de nombreux types de tissus humains, meurent souvent lorsqu'elles sont introduites chez les animaux en raison des besoins physiologiques différents des espèces.
Liangxue Lai, biologiste des cellules souches des Instituts de biomédecine et de santé de Guangzhou en Chine, et son équipe ont passé plus de cinq ans à perfectionner leurs méthodes pour améliorer la survie des cellules souches humaines.
Alors que les embryons de porc n'étaient encore que des cellules uniques, l'équipe a utilisé l'outil d'édition génétique CRISPR/Cas9 pour supprimer deux gènes nécessaires au développement du rein. Cela a créé un environnement propice au développement des CSPiH en cellules rénales une fois injectées dans l'espace. Les cellules souches humaines ont également été modifiées pour avoir des gènes particulièrement actifs qui atténuent l'apoptose, ou la mort cellulaire, afin de maintenir les cellules en vie suffisamment longtemps pour s'enraciner et commencer à former le rein.
Plus de 1800 embryons ont ensuite été transférés chez des truies porteuses, dont cinq ont été récoltés pour l'étude au cours des 28 premiers jours. Les cinq avaient des reins normaux, conformes à leur stade de développement, et les organes contenaient de 50% à 60% de cellules d'origine humaine. C'est le pourcentage le plus élevé de cellules humaines jamais observé dans un organe cultivé à l'intérieur d'un porc, déclare Tan. Avec plus de temps, rien n'indique que les reins ne continueraient pas à se développer et à se former normalement, les cellules humaines ayant potentiellement de plus en plus d'emprise sur les cellules de porc, expliquent les chercheurs.
L'étude est "une étape importante et intéressante", déclare Massimo Mangiola, immunologiste de transplantation à la New York University Langone Health, qui n'a pas participé à la recherche. Mais il faudra encore de nombreuses années pour parvenir à des xénotransplantations pleinement fonctionnelles, note-t-il.
Les cellules souches se sont différenciées en plusieurs types cellulaires, y compris des cellules tubulaires rénales et des tissus de développement, mais le rein humain comporte plus de 70 types de cellules uniques que les scientifiques devront reproduire. Et tant que les chercheurs ne pourront pas créer un organe constitué à 100% de cellules humaines, il est probable que de telles greffes entraîneront un rejet.
De plus, quelques CSPiH se sont différenciées de manière erronée en cellules nerveuses dans le cerveau et la moelle épinière des embryons. Mangiola affirme que ces cellules semblent aléatoires, contrairement aux cellules rénales, ce qui le fait penser qu'elles ne sont pas susceptibles de donner des animaux avec des cerveaux humains - ce qui pose un dilemme éthique.
Pour éviter ces problèmes éthiques, Lai déclare que l'équipe supprimera les gènes qui orchestrent la différenciation des cellules souches en neurones - ainsi qu'en cellules germinales, ovules et spermatozoïdes, qui transmettent l'information génétique à la descendance. L'équipe s'efforce également de cultiver d'autres précurseurs d'organes humains chez les porcs, notamment le cœur et le pancréas.
"Nous estimons avoir franchi une étape importante dans ce domaine, mais ce n'est que le premier pas et de nombreux défis restent à relever", déclare Lai. "Nous sommes optimistes quant à notre capacité à surmonter ces défis avec le temps et les efforts accomplis."




