Científicos cultivan riñones humanizados en embriones de cerdo
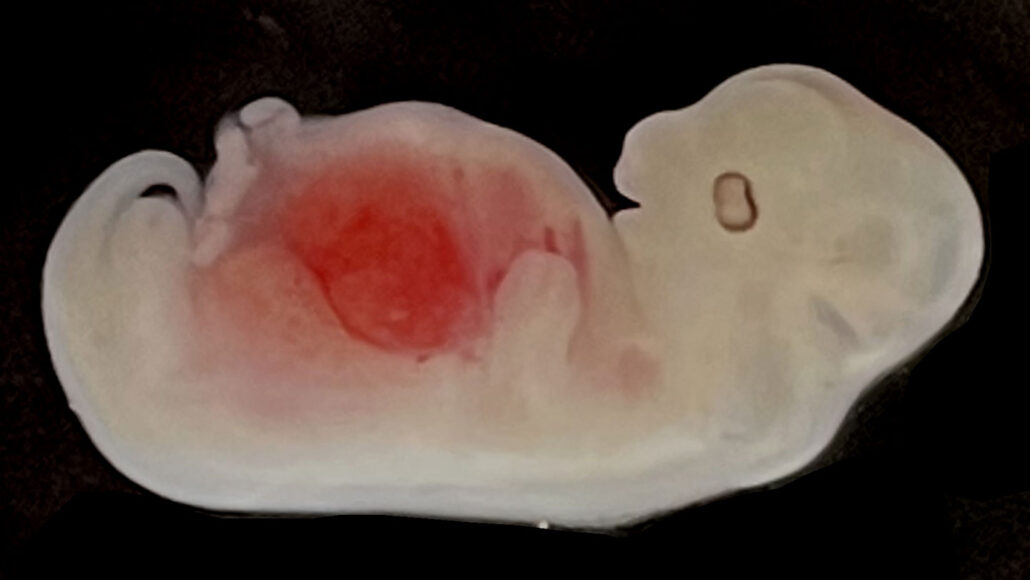
Los científicos han conseguido cultivar riñones compuestos principalmente de células humanas dentro de embriones de cerdo, lo que supone un paso más en el largo camino hacia la generación de órganos humanos viables para trasplantes.
Los resultados, publicados el 7 de septiembre en Cell Stem Cell, marcan la primera vez que un órgano humanizado sólido, que contiene células humanas y animales, se cultiva dentro de otra especie.
“Se trata de un progreso considerable en el quimerismo humano-animal”, afirma Tao Tan, biólogo celular de la Universidad de Ciencia y Tecnología de Kunming (China), que ayudó a crear el primer embrión quimérico de humano-mono en 2021, pero que no participó en el proyecto actual. estudiar.
Sólo en Estados Unidos, más de 100.000 personas se encuentran actualmente en lista de espera para trasplante de órganos. Una gran mayoría de esas personas necesitan un trasplante de riñón. Para satisfacer esta demanda de trasplantes de órganos que salvan vidas, los científicos han estado buscando nuevos métodos para cultivar órganos y tejidos en animales (SN: 26/01/17).
Los avances de los últimos años incluyen el cultivo de órganos de rata en ratones (y viceversa) y músculo esquelético humanizado y tejido endotelial en cerdos. Pero aún quedan obstáculos importantes, debido en parte a lo difícil que resulta para las células humanas prosperar dentro de un huésped extraño. Las células madre pluripotentes inducidas por humanos, o iPSC, que funcionan como una especie de “kit de inicio” para cultivar muchos tipos de tejido humano, a menudo mueren cuando se introducen en animales porque las células de cada especie tienen necesidades fisiológicas diferentes.
El biólogo de células madre Liangxue Lai, de los Institutos de Biomedicina y Salud de Guangzhou en China, y su equipo pasaron más de cinco años perfeccionando sus métodos para mejorar la capacidad de supervivencia de las células madre humanas.
Si bien los embriones de cerdo todavía eran células individuales, el equipo utilizó la herramienta de edición de genes CRISPR/Cas9 para eliminar dos genes necesarios para el desarrollo del riñón. Eso creó un nicho en el que las iPSC humanas, una vez inyectadas en el espacio, podrían convertirse en células renales. Las células madre humanas también fueron modificadas para que tuvieran genes especialmente activos que inhiben la apoptosis, o muerte celular, para mantenerlas vivas el tiempo suficiente para afianzarse y comenzar a formar el riñón.
Luego se transfirieron más de 1.800 embriones a cerdas sustitutas, de las cuales cinco se recolectaron para su estudio dentro de los primeros 28 días. Los cinco tenían riñones normales acordes con su nivel de desarrollo, y los órganos contenían entre un 50 y un 60 por ciento de células de origen humano. Ese es el porcentaje más alto de células humanas observado hasta ahora en cualquier órgano cultivado dentro de un cerdo, dice Tan. Con más tiempo, no hay indicios de que los riñones no continuarían creciendo y desarrollándose normalmente, posiblemente con las células humanas superando cada vez más a las células de cerdo, dicen los investigadores.
El estudio es "un paso importante e interesante", dice Massimo Mangiola, inmunólogo de trasplantes de Langone Health de la Universidad de Nueva York que no participó en la investigación. Pero todavía faltan muchos años para que los xenotrasplantes sean completamente funcionales, señala.
Si bien las células madre se diferenciaron en varios tipos de células, incluidas las células tubulares del riñón y el tejido del desarrollo, el riñón humano tiene más de 70 tipos de células únicos que los científicos necesitarán recapitular. Y hasta que los investigadores puedan crear un órgano que sea 100 por ciento humano, es probable que dichos trasplantes provoquen rechazo.
Además, algunas iPSC se diferenciaron erróneamente en células neurales en el cerebro y la médula espinal de los embriones. Mangiola dice que las células parecen ser aleatorias, a diferencia de las células del riñón, lo que le hace pensar que no es probable que den lugar a animales con cerebro humano, lo que crearía un dilema ético.
Para evitar tales problemas éticos, Lai dice que en el futuro el equipo eliminará los genes que organizan la diferenciación de las células madre en neuronas, así como en células de la línea germinal, óvulos y espermatozoides, que transmiten información genética a la descendencia. El equipo también busca cultivar otros precursores de órganos humanos en cerdos, incluidos el corazón y el páncreas.
"Creemos que hemos logrado un hito en este campo, pero este es sólo el primer paso y aún quedan muchos desafíos por delante", afirma Lai. "Somos optimistas de que con tiempo y esfuerzo también podremos superar estos desafíos".




