Menschliche Embryo-Nachbildungen sind komplexer geworden. Hier ist, was Sie wissen müssen.
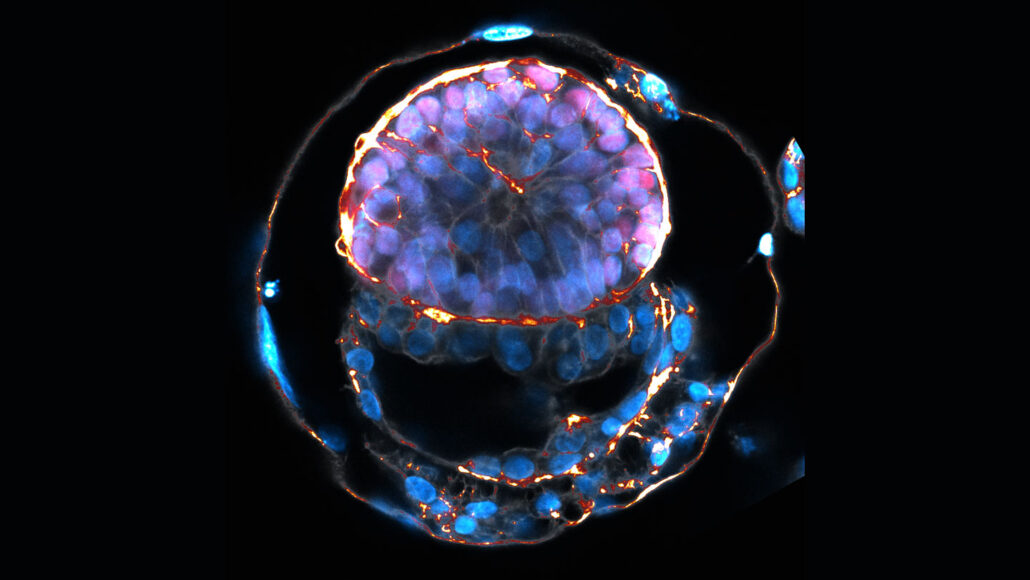
Einige neu gemeldete Zellklumpen, die in Laborschalen wachsen, wurden als die bisher am nächsten an menschlichen Embryos gemachten Dinge im Labor gefeiert.
Diese Gebilde sind menschliche Embryo-Modelle - Zellmassen, die aus Stammzellen hergestellt werden und gewisse Eigenschaften bestimmter Embryoentwicklungsstadien nachahmen. Dieser Fortschritt gibt Forschern die Möglichkeit, die menschliche Entwicklung über die erste Woche hinaus zu betrachten, in der ein Embryo im Mutterleib implantiert werden muss, um sich weiterzuentwickeln. Diese post-Implantationsphase wurde bisher nicht in Laborschalen nachgebildet - bis jetzt.
Sechs Studien aus den Monaten Juni und Juli beschreiben die Embryo-Modelle, die gleichermaßen Begeisterung und Bedenken hervorrufen.
Für Forscher, die an diesen Embryo-Modellen arbeiten, sind die künstlichen Embryos neue Werkzeuge, um Einblicke in die "Black Box" der menschlichen Entwicklung nach der Implantation im Mutterleib zu gewinnen. Sie sind nützlich, da gespendete menschliche Embryos knapp sind und es Grenzen für die Arten von Experimenten gibt, die Forscher durchführen können.
Rund 60 Prozent der Schwangerschaften scheitern kurz vor, während oder kurz nach der Implantation, sagte die Entwicklungs- und Stammzellbiologin Magdalena Żernicka-Goetz von der Universität Cambridge und Caltech am 27. Juni während einer Pressekonferenz, bei der ein in ihrem Labor hergestelltes Embryo-Modell diskutiert wurde. Die aus den Embryo-Modellen gewonnenen Erkenntnisse könnten ein neues Verständnis dafür liefern, warum viele Schwangerschaften nicht erfolgreich sind, und zu besseren Fruchtbarkeitsbehandlungen führen, so Żernicka-Goetz.
Aber andere befürchten, dass die Modelle - zusammen mit aus Stammzellen hergestellten Eiern und Spermien - die Möglichkeit eröffnen, dass Forscher die Nachahmungen verwenden, um Babys zu erzeugen. Die Wissenschaftler, die an den Modellen arbeiten, sagen, dass Reproduktion nicht ihr Ziel oder ihre Absicht ist und dass eine Implantation im Mutterleib mit diesen Embryo-Modellen unmöglich ist.
Trotzdem wirft die Forschung Fragen darüber auf, wie - und ob - reguliert werden soll, was Wissenschaftler mit aus Stammzellen hergestellten Embryo-ähnlichen Gebilden tun können. Es gibt Fragen darüber, ob Embryo-Modelle über das Äquivalent von 14 Tagen normaler menschlicher Entwicklung nach der Befruchtung hinaus wachsen könnten oder sollten. Kritiker warnen auch davor, dass eine Verharmlosung dessen, was die Modelle sind oder können, das Vertrauen in die Wissenschaft gefährden könnte.
Die Science News sprach mit Wissenschaftlern und Ethikern, um mehr über diese menschlichen Embryo-Modelle zu erfahren.
Bevor diese Frage beantwortet wird, sagt Amander Clark, Präsidentin der International Society for Stem Cell Research, müssen wir zunächst verstehen, dass ein menschlicher Embryo das Produkt der Befruchtung einer Eizelle und einer Samenzelle ist.
Embryo-Modelle hingegen setzen sich aus pluripotenten Stammzellen selbst zusammen - solche, die die Fähigkeit haben, fast jeden Zelltyp im Körper zu bilden. "Deshalb erfüllen Embryo-Modelle nicht die klinische, medizinische oder wissenschaftliche Definition eines Embryos, weil sie nicht aus dem Produkt der Befruchtung von zwei Gameten entstehen", sagt Clark, eine Stammzellforscherin, Entwicklungsbiologin und Genetikerin an der UCLA.
Wissenschaftler haben jahrelang die erste Woche oder so der menschlichen Entwicklung mit gespendeten menschlichen Embryos oder Embryo-Modellen untersucht. Anhand dieser Forschung haben sie viel über die Bildung des Zellhaufens, bekannt als Blastozyste, gelernt. Blastozysten bestehen aus einer äußeren Zellschicht, die die Plazenta und andere Stützsysteme für den sich entwickelnden Embryo bildet, sowie aus einem inneren Zellhaufen, aus dem der Körper entsteht.
Erhalten Sie großartigen Wissenschaftsjournalismus von der vertrauenswürdigsten Quelle direkt nach Hause geliefert.
Aber in den nächsten Wochen passiert das eigentliche Geschehen, sagt der Stammzellbiologe und Embryologe Jacob Hanna vom Weizmann Institute of Science in Rehovot, Israel. Zwischen dem siebten und etwa dem 35. Tag nach der Befruchtung baut der Embryo all seine Organe auf. "Er verwandelt sich von einem Zellhaufen in eine Struktur, die jeder auf der Straße als Embryo bezeichnen würde. Und dann besteht der Rest der anderen acht Monate nur aus dem Wachstum des Embryos", sagt er.
Forscher haben Embryo-Modelle entwickelt, die einige, aber nicht alle notwendigen Zelltypen für eine normale Entwicklung enthalten. Die neu gemeldeten Embryo-Modelle ahmen Strukturen nach, die bei einem in den Mutterleib implantierten Embryo gefunden würden, obwohl den Nachahmungen nichts zum Implantieren zur Verfügung steht. Die Modelle simulieren ein sehr spezifisches Fenster der Embryo-Entwicklung: "die Ereignisse, die auftreten, wenn sich ein Embryo implantiert, wie sich das Embryo selbst zusammensetzt", sagt Clark. "Dann brechen sie im Wesentlichen zusammen."
Keines der Modelle kopiert vollständig einen echten Embryo, sagt sie. Zum Beispiel ist keines ein sehr guter Trophektoderm, die Zellschicht, aus der später in der Entwicklung die Plazenta entsteht. Diese Schicht ist wichtig, damit ein Embryo sich in den Mutterleib einnisten kann, und sendet auch Signale, die dem Rest des Embryos dabei helfen, sich ordnungsgemäß zu entwickeln.
Post-Implantationsmodell für Embryonen zogen öffentliche Aufmerksamkeit auf sich, als Żernicka-Goetz vorläufige Ergebnisse in den Abschlussmomenten eines Vortrags präsentierte, den sie am 13. Juni in Boston bei einer Versammlung der International Society for Stem Cell Research hielt. Die Zeitung The Guardian bezeichnete die Arbeit als Durchbruch, der synthetische menschliche Embryonen geschaffen hat.
Diese Charakterisierung übertreibt den Erfolg, sagt Alfonso Martinez Arias, ein Entwicklungsbiologe an der Pompeu Fabra University in Barcelona. Die Arbeit ist kein Durchbruch, sondern ein schrittweiter Fortschritt und liegt weit entfernt davon, einen Embryo neu zu erzeugen, sagt er.
Żernicka-Goetz und Kollegen haben menschliche Stammzellen genetisch manipuliert, um drei Arten von Zellen zu erzeugen, die für die Entwicklung des Embryos notwendig sind: Zellen, die das wichtige plazentabildende Trophektoderm imitieren, Zellen, die jenen ähneln, die den Dottersack bilden, der den Embryo ernährt, bis die Plazenta übernimmt, und Zellen, die das Epiblast bilden - die Zellen im Inneren des Embryos, die sich zu Organen entwickeln werden. Das resultierende Zellgebilde ähnelt einigen Aspekten menschlicher Embryonen, berichtete das Team am 27. Juni in Nature.
Beispielsweise bildet sich wie bei Embryonen die Trophektoderm-Schicht an der Außenseite der embryoähnlichen Struktur. Aber sie produziert keine typischen Proteine für diese Schicht, wenn sie in einer 3D-Struktur zusammengebaut wird, daher handelt es sich nicht um ein tatsächliches pränatales Gewebe, sagte Co-Autor Bailey Weatherbee von der University of Cambridge während der Pressekonferenz. Aber die Schicht ist für die Bildung des restlichen Embryomodells notwendig, was darauf hinweist, dass sie einige Funktionen des Trophektoderms erfüllt, sagte sie.
Wie Żernicka-Goetz's Team begannen alle Forschungsgruppen mit menschlichen Stammzellen. Durch sorgfältige Kontrolle der Wachstumsbedingungen und der Anzahl bestimmter Zelltypen, die dem Zellsystem hinzugefügt wurden, konnten die Stammzellen sich zu embryoähnlichen Strukturen entwickeln. Die Modelle unterscheiden sich in der Anzahl der Zelltypen, die sie enthalten, und in den Merkmalen realer Embryonen, die sie nachbilden können.
Eine Gruppe von Forschern überredete Stammzellen, embryoähnliche Strukturen mit zwei Gewebsschichten zu bilden. Diese Arbeit, die ebenfalls am 27. Juni in Nature beschrieben wurde, nutzte weder genetische Manipulation noch Chemikalien, um die Stammzellen zur Bildung der embryoähnlichen Strukturen anzuregen. Stattdessen verließen sich die Forscher auf die Fähigkeit der Stammzellen zur Selbstorganisation, sagt Entwicklungsbiologin Berna Sozen von der Yale School of Medicine.
Das resultierende Modell fehlt das Trophektoderm. Als die Forscher bemerkten, dass das Gewebe fehlte, dachten sie, dass sein Fehlen ihnen etwas über seine Bedeutung sagen könnte, sagt sie. "In Abwesenheit dieser Gewebe kann man sehen, was passieren wird, was nicht passiert, und dann erhält man sehr starke wissenschaftliche Erkenntnisse darüber, warum man dieses Gewebe braucht."
Laut Martinez Arias ist ein weiterer Versuch von Forschern in China und Michigan, der am 16. Juni noch nicht begutachtet auf bioRxiv.org veröffentlicht wurde, technisch beeindruckend. Aber es fehlt immer noch eine Vorläufer-Schicht der Plazenta.
Zuletzt überzeugte ein Team unter der Leitung von Jun Wu vom UT Southwestern Medical Center in Dallas Stammzellen, embryoähnliche Gebilde zu formen, die den Umbauvorgang namens Gastrulation umspannen, berichten die Forscher am 20. Juli in Cell. Während der Gastrulation entwickeln sich Embryonen von hohlen Zellkugeln zu mehrschichtigen Strukturen, die zu Organen und Geweben heranreifen, die den Körper bilden.
Diese "peri-gastruloiden" Modelle erzeugten einige Gewebe, die denen im frühen Nervensystem ähneln, und könnten dazu beitragen, die Herkunft von Zellen zu bestätigen, die Eier und Spermien bilden werden. Diese Modelle enthalten auch einen Dottersack, aber "unser Modell ist nicht vollständig", sagt Wu. "Wir haben kein Plazentagewebe."
Weil den Modellen das Trophektoderm fehlt, mussten die Forscher Proteine hinzufügen, um die Gastruloide zu verankern und zu unterstützen, damit sie sich richtig entwickeln können.
Ein Forscherteam in China berichtete am 28. Juni vorläufige Ergebnisse ähnlicher Gastruloide mit Dottersäcken auf bioRxiv.org. Das Team stellte fest, dass das chemische Mittel Thalidomid die Bildung der Gewebeschichten beeinflusst und die Entwicklung unterbricht.
In Zukunft könnten Forscher solche Modelle nutzen, um zu verstehen, wie Chemikalien aus der Umwelt die Entwicklung von Embryonen beeinflussen könnten, sagt Wu.
Martinez Arias und andere haben zuvor bereits Gastruloide hergestellt, die die Entwicklung bis zum 19. Tag nach der Befruchtung modellieren konnten, aber diese früheren Modelle hatten keinen Dottersack.
Von diesem "Goldrausch" an Embryomodellen sind nur zwei richtige Fortschritte, sagt Martinez Arias: Wus Gastruloide und Embryomodelle von Hannas Gruppe.
Hannas Modelle, die in einer am 15. Juni auf bioRxiv.org veröffentlichten Vorabversion beschrieben sind, haben einen vernünftigen Nachbau sowohl eines Dottersacks als auch eines Plazentavorläufers, sagt Martinez Arias, und bilden Strukturen mit einer "verblüffenden" Ähnlichkeit zu Embryonen in der 14. Entwicklungswoche.
Der Prozess zur Erforschung eines Embryo-Modells, das dem echten so nahe kommt wie möglich, war ein langer, sagt Hanna. Sein Team fand zuerst heraus, wie man Maus-Embryos über diese Entwicklungsstufe hinaus in Laborschalen züchtet. Indem sie Maus-Embryos als "experimentellen Kompass" nutzten, fanden die Forscher dann heraus, wie man ein Maus-Embryo-Modell aus Stammzellen zusammenstellt. Von dort aus nutzte das Team die Tricks, die sie gelernt hatten, um menschliche Stammzellen unter Bedingungen wachsen zu lassen, die sie dazu veranlassten, sich selbst zu Strukturen ähnlich postimplantierter Embryos zusammenzusetzen.
Das Selbstzusammensetzen umging die Blastozystenstufe und bewegte sich direkt zu etwas Ähnlichem wie einem postimplantierten Embryo, fand sein Team heraus. "Vielleicht sind die Embryo-Modelle mangelhaft, weil wir die Blastozystenstufe nicht durchlaufen. Ich glaube nicht daran. Aber im Moment kann ich es nicht ausschließen", sagt Hanna.
Nein, aber diese Frage wird immer wieder gestellt.
Wissenschaftler sind an den technischen und biologischen Fortschritten, die die neuen Embryo-Modelle bringen, interessiert. Aber für die meisten Menschen ist es vor allem die Möglichkeit, dass sie für die Fortpflanzung genutzt werden könnten, die die Aufmerksamkeit auf sich zieht", sagt Katie Hasson, stellvertretende Direktorin des Center for Genetics and Society, einer gemeinnützigen Organisation für soziale Gerechtigkeit mit Sitz in Berkeley, Kalifornien.
Es ist nicht möglich, diese Embryo-Modelle zur Fortpflanzung zu nutzen, sagen Wissenschaftler. "Es ist nicht nur illegal, diese späten Entwicklungsstadien von Embryo-Modellen in die Gebärmutter einzusetzen, sondern tatsächlich können diese Strukturen sich niemals einnisten", sagt Hanna. Die Einnistung erfolgt nur, wenn Embryos aus einer bis 64 Zellen bestehen. Diese postimplantierten Modelle haben diese Phase überwunden. Biologisch gesehen, "wird es niemals erfolgreich sein", sagt er.
Wu stimmt zu. "Diese Modelle sind überhaupt keine menschlichen Embryonen", sagt er. "Sie können kein Leben erzeugen. Sie sind im Wesentlichen nur eine Zellansammlung."
Es gibt auch rechtliche Blockaden, um Embryos im Labor über eine bestimmte Stufe hinaus zu züchten. In Großbritannien verbietet das Gesetz das Wachstum von Embryos über 14 Tage Entwicklung, dem Zeitpunkt, an dem der Embryo sein Körperbildungsschema einschaltet. Diese Grenze wurde kurz nach Einführung der In-vitro-Fertilisation eingeführt.
Aber einige dieser Embryo-Modelle ähneln bereits Embryos im Entwicklungsstadium von 14 Tagen. Da die Modelle nicht durch Befruchtung entstehen und niemals zu einer Person heranwachsen könnten, argumentieren einige Forscher, dass sie nicht der 14-Tage-Regel unterliegen sollten.
In den Vereinigten Staaten gibt es kein Gesetz, das das Wachstum von Embryos über 14 Tage hinaus verbietet, aber der Dickey-Wicker-Zusatz von 1995 verbietet dem Nationalen Gesundheitsinstitut der USA die Finanzierung von Forschung an Embryos oder embryonischen Zellen mit "organismalem Potenzial", sagt Clark. Da diese Modelle wichtige Bestandteile vermissen, haben sie kein Potenzial, einen Organismus zu bilden - daher können Forschungen mit Embryo-Modellen finanziert werden.
Die internationale Stammzellgesellschaft hat kürzlich ihre Richtlinien aktualisiert und vorgeschlagen, dass Wissenschaftler, wenn sie Embryos, die durch Befruchtung erzeugt wurden, länger als 14 Tage kultivieren wollen, die Zustimmung der Öffentlichkeit in ihrer Gerichtsbarkeit einholen müssen. Da es sich bei den Modellen nicht um Embryos handelt, schlagen die Richtlinien der Gesellschaft vor, dass sie bis zur Bildung einer Struktur namens Primitivstreifen kultiviert werden können, was signalisiert, dass der Embryo dabei ist, den Körper zu bilden.
Das Ziel der meisten Wissenschaftler auf diesem Gebiet ist es, den Prozess zu verstehen, durch den Zellen einen Embryo aufbauen und dann alle Organe und Gewebe des Körpers bilden, sagt Martinez Arias. Es ist weder notwendig noch wünschenswert, und vielleicht nicht einmal möglich, eine perfekte Kopie eines Embryos zu schaffen. "Ich denke sicherlich nicht, dass das etwas ist, das wir tun wollen oder sollten oder sagen sollten", sagt er. "Und das steht auch nicht bevor."
Trotzdem müssen Wissenschaftler innehalten, um die embryoähnlichen Strukturen gründlich zu untersuchen und herauszufinden, wie sie zur Erforschung der menschlichen Entwicklung beitragen können, sagt Martinez Arias. "Ich hoffe, dass wir jetzt alle diese Systeme auf eine Art und Weise entwickeln können, die für die Forschung nützlich ist, anstatt zu versuchen, herauszufinden, wie weit wir ins All gehen können, ohne darüber nachzudenken, wie wir zurückkehren."
Gespräche mit der Öffentlichkeit darüber, was die Embryo-Modelle wissenschaftlich, philosophisch und rechtlich darstellen und wie sie ethisch eingesetzt werden können, müssen jetzt beginnen, sagt Hasson. "Wir sollten jetzt darüber nachdenken, denn es sollte nicht so sein, dass die technischen Grenzen dessen, was Wissenschaftler derzeit mit diesen Modellen tun können, die ethische Diskussion und die ethischen Grenzen bestimmen."
Unsere Mission ist es, genaue, fesselnde Nachrichten aus der Wissenschaft an die Öffentlichkeit zu liefern. Diese Mission war noch nie so wichtig wie heute.-
Als gemeinnützige Nachrichtenorganisation können wir es nicht ohne Sie tun.
Your support enables us to keep our content free and accessible to the next generation of scientists and engineers. Invest in quality science journalism by donating today.




