Réplicas de embriones humanos se han vuelto más complejas. Aquí está lo que necesitas saber.
Algunas masas de células recientemente informadas que crecen en platos de laboratorio han sido aclamadas como las cosas más parecidas a embriones humanos que los científicos han creado en el laboratorio.
Estas entidades son modelos de embriones humanos: masas de células creadas a partir de células madre que imitan algunas propiedades de ciertas etapas del desarrollo del embrión. El logro brinda a los investigadores la oportunidad de observar el desarrollo humano más allá de la primera semana aproximadamente, cuando un embrión debe implantarse en el útero para desarrollarse aún más. Esa etapa posterior a la implantación no se había recreado en platos de laboratorio, hasta ahora.
Seis estudios informados en junio y julio describen los modelos de embriones, que han generado entusiasmo y preocupación por igual.
Para los investigadores que trabajan en estos modelos de embriones, los embriones falsos son nuevas herramientas para comprender el "cajón negro" del desarrollo humano, después de la implantación de los embriones en el útero. Son útiles porque los embriones humanos donados son escasos y existen límites en los tipos de experimentos que los investigadores pueden realizar con ellos.
Aproximadamente el 60 por ciento de los embarazos fallan justo antes, durante o poco después de la implantación, según Magdalena Żernicka-Goetz, bióloga del desarrollo y de células madre de la Universidad de Cambridge y Caltech, durante una rueda de prensa el 27 de junio en la que se discutió un modelo de embrión creado en su laboratorio. Los conocimientos obtenidos de los modelos de embriones pueden brindar una nueva comprensión de por qué muchos embarazos no logran afianzarse y llevar a mejores tratamientos de fertilidad, dijo Żernicka-Goetz.
Pero otros se preocupan de que los modelos, junto con óvulos y espermatozoides creados a partir de células madre, planteen la posibilidad de que los investigadores utilicen los modelos para crear bebés. Los científicos que desarrollan los modelos afirman que la reproducción no es su objetivo ni su intención, y que es imposible la implantación de estos modelos de embriones en un útero.
Sin embargo, la investigación plantea cuestiones sobre cómo y si se debe regular lo que los científicos pueden hacer con entidades similares a embriones creadas a partir de células madre. Se plantean preguntas sobre si los modelos de embriones podrían o deberían ser cultivados más allá del equivalente a 14 días de desarrollo humano normal después de la fertilización. Y los críticos advierten que exagerar lo que los modelos son o pueden hacer podría poner en riesgo la confianza en la ciencia.
Science News habló con científicos y éticos para obtener más información sobre estos modelos de embriones humanos.
Antes de responder a esa pregunta, Amander Clark, presidenta de la Sociedad Internacional de Investigación de Células Madre, dice que primero debemos entender que un embrión humano es el producto de la fertilización de un óvulo y un espermatozoide.
Los modelos de embriones, por otro lado, se autoensamblan a partir de células madre pluripotentes, aquellas que tienen el poder de convertirse en casi cualquier tipo de célula en el cuerpo. "Por lo tanto, los modelos de embriones no cumplen con la definición clínica, médica o científica de un embrión porque no se originan a partir del producto de la fertilización de dos gametos", dice Clark, científica de células madre, bióloga del desarrollo y genetista en UCLA.
Durante años, los científicos han estudiado la primera semana aproximada de desarrollo humano utilizando embriones humanos donados o modelos de embriones. A partir de ellos, los investigadores han aprendido mucho sobre la formación de la bola de células conocida como blastocisto. Los blastocistos tienen una capa externa de células que formarán la placenta y otros sistemas de soporte para el embrión en desarrollo, y un cúmulo interno de células que darán origen al cuerpo.
Obtén un gran periodismo científico, de la fuente más confiable, entregado en tu puerta.
Pero es en las siguientes semanas de vida cuando ocurren las verdaderas acciones, según Jacob Hanna, biólogo de células madre y embriólogo del Instituto Weizmann de Ciencias de Rehovot, Israel. Entre el día siete y aproximadamente el día 35 después de la fertilización es cuando el embrión forma todos sus órganos. "Pasa de ser una bola de células a una estructura que cualquiera en la calle ... te diría: 'Esto es un embrión'. Y luego, los otros ocho meses son simplemente el crecimiento del embrión", dice.
Los investigadores han ensamblado modelos de embriones que contienen algunos, pero no todos, los tipos de células necesarias para un desarrollo normal. Los modelos de embriones recién informados imitan estructuras que se encontrarían en un embrión implantado en un útero, aunque las imitaciones no tienen nada en qué implantarse. Los modelos simulan una ventana muy específica del desarrollo embrionario: "los eventos que ocurren cuando un embrión se implanta, cómo el embrión se autoensambla", dice Clark. "Luego, básicamente se derrumban".
Ninguno de los modelos copia completamente a un embrión real, dice. Por ejemplo, ninguno forma trofoblasto, la capa de células que dará origen a la placenta más adelante en el desarrollo. Esa capa es importante para que un embrión se implante en el útero, y también envía señales que ayudan al desarrollo adecuado del resto del embrión.
Los modelos de embriones postimplantación atrajeron la atención de los medios cuando Żernicka-Goetz presentó hallazgos preliminares en los últimos momentos de una charla que dio el 13 de junio en Boston en una reunión de la Sociedad Internacional de Investigación de Células Madre. El periódico The Guardian calificó el trabajo como un avance que creó embriones humanos sintéticos.
Esa caracterización exagera el logro, dice Alfonso Martinez Arias, biólogo del desarrollo en la Universidad Pompeu Fabra de Barcelona. El trabajo no es un avance, sino un avance incremental, y está lejos de recrear un embrión, dice él.
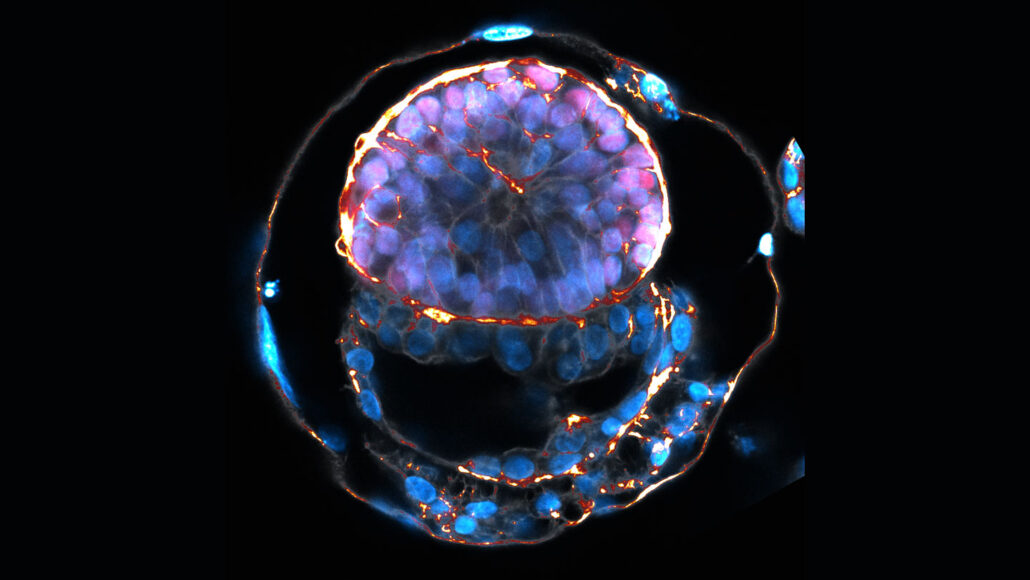
Żernicka-Goetz y sus colegas modificaron genéticamente células madre humanas para que se parecieran a tres tipos de células necesarias para el desarrollo del embrión: células que imitan al importante trofoblasto que genera la placenta, células que se asemejan a las que formarán el saco vitelino que alimentará al embrión hasta que la placenta se haga cargo, y células que formarán el epiblasto -las células dentro del embrión que se desarrollarán en el cuerpo. El equipo informó el 27 de junio en Nature que las esferas resultantes de células se asemejan a algunos aspectos de los embriones humanos.
Por ejemplo, la capa del trofoblasto se forma en el exterior de la estructura similar a un embrión como lo hace en los embriones. Pero no produce proteínas típicas de esa capa cuando se ensambla en una estructura 3D, por lo que no es realmente un precursor de placenta, dijo la coautora Bailey Weatherbee de la Universidad de Cambridge durante la rueda de prensa. Pero la capa es necesaria para que el resto del modelo de embrión se ensamble, lo que sugiere que realiza algunas de las funciones del trofoblasto, dijo.
Al igual que el equipo de Żernicka-Goetz, todos los grupos de investigación comenzaron con células madre humanas. El control cuidadoso de las condiciones de crecimiento y el número de ciertos tipos de células agregadas a la mezcla permitieron que las células madre se convirtieran en estructuras similares a embriones. Los modelos difieren en el número de tipos de células que contienen y en las características de los embriones reales que pueden imitar.
Un grupo de investigadores persuadió a las células madre para que formaran estructuras similares a embriones con dos capas de tejido. Ese trabajo, también descrito el 27 de junio en Nature, no usó manipulación genética ni productos químicos para inducir a las células madre a formar estructuras similares a embriones. En cambio, los investigadores confiaron en la capacidad de las células madre para autoorganizarse, según la bióloga del desarrollo Berna Sozen de la Escuela de Medicina de Yale.
El modelo resultante carece del trofoblasto. Cuando los investigadores se dieron cuenta de que faltaba el tejido, pensaron que su ausencia podría indicarles algo sobre su importancia, dice ella. "En ausencia de estos tejidos, puedes ver qué sucederá, qué no sucederá, y luego obtienes ideas científicas muy sólidas sobre por qué necesitas ese tejido".
Otro esfuerzo realizado por investigadores en China y Michigan, descrito en un preprint que aún no ha sido revisado por pares y publicado el 16 de junio en línea en bioRxiv.org, es técnicamente impresionante, según Martinez Arias. Pero aún le falta una capa precursora de la placenta.
Recientemente, un equipo liderado por Jun Wu del Centro Médico UT Southwestern en Dallas persuadió a las células madre para que formaran entidades similares a embriones que abarcan el evento de reorganización llamado gastrulación, informan los investigadores el 20 de julio en Cell. Durante la gastrulación, los embriones pasan de ser esferas huecas de células a estructuras multicapa que darán origen a órganos y tejidos que formarán el cuerpo.
Estos modelos denominados 'peri-gastruloides' formaron algunos tejidos que se asemejan a los del sistema nervioso temprano y pueden ayudar a confirmar el origen de las células que darán origen a los óvulos y espermatozoides. Estos modelos también contienen un saco vitelino, pero "nuestro modelo no es completo", dice Wu. "No tenemos el tejido de la placenta".
Debido a que los modelos carecen del trofoblasto, los investigadores tuvieron que agregar proteínas para anclar y respaldar los gastruloides para que puedan desarrollarse correctamente.
Un equipo de investigadores en China informó resultados preliminares de gastruloides similares con sacos vitelinos el 28 de junio en bioRxiv.org. Ese equipo descubrió que el fármaco talidomida altera la formación de las capas de tejido e interrumpe el desarrollo.
En el futuro, los investigadores podrían utilizar dichos modelos para comprender cómo los productos químicos del medio ambiente podrían afectar el desarrollo de los embriones, según Wu.
Martinez Arias y otros ya habían creado gastruloides que podrían modelar el desarrollo hasta el día 19 después de la fertilización, pero esos modelos anteriores no tenían sacos vitelinos.
De este "auge" de modelos de embriones, solo dos son avances reales, dice Martinez Arias: los gastruloides de Wu y los modelos de embriones creados por el grupo de Hanna.
Los modelos de Hanna, descritos en un preprint publicado el 15 de junio en bioRxiv.org, tienen una similitud razonable tanto con el saco vitelino como con el precursor de la placenta, dice Martinez Arias, y crean estructuras con una "asombrosa" semejanza a las de los embriones a los 14 días de desarrollo.
El proceso para lograr un modelo de embrión que se asemeje tanto al real fue largo, dice Hanna. Su equipo primero descubrió cómo cultivar embriones de ratón más allá de esta etapa de desarrollo en platos de laboratorio. Utilizando embriones de ratón como su "brújula experimental", los investigadores luego descubrieron cómo ensamblar un modelo de embrión de ratón a partir de células madre. A partir de ahí, el equipo utilizó los trucos que habían aprendido para cultivar células madre humanas en condiciones que las incitaron a autoensamblarse en estructuras que se asemejan a embriones de post-implantación.
El autoensamblaje evitó la etapa de blastocisto y pasó directamente a algo similar a un embrión de post-implantación, encontró su equipo. "Tal vez los [modelos] de embrión son deficientes porque no pasamos por la etapa de blastocisto. No creo. Pero no puedo descartarlo en este momento", dice Hanna.
No, pero esa pregunta siempre surge.
Los científicos están interesados en los avances técnicos y biológicos que los nuevos modelos de embrión traen consigo. Pero para la mayoría de las personas, "es realmente la posibilidad de que puedan usarse para la reproducción lo que llama la atención", dice Katie Hasson, directora asociada del Center for Genetics and Society, una organización sin fines de lucro de justicia social con sede en Berkeley, California.
No es posible utilizar estos modelos de embrión para la reproducción, dicen los científicos. "No solo es ilegal colocar estos modelos de [embrión] de etapa tardía dentro del útero, sino que en realidad, si quisiera, o si alguien quisiera, estas estructuras nunca podrían implantarse", dice Hanna. La implantación solo ocurre cuando los embriones consisten en una a 64 células. Estos modelos de post-implantación han superado esa etapa. Biológicamente, él dice, "nunca tendrá éxito".
Wu está de acuerdo. "Estos modelos no son embriones humanos en absoluto", dice. "No son capaces de generar ningún tipo de vida. Básicamente son solo un conglomerado de células".
También hay barreras legales para cultivar embriones en el laboratorio más allá de cierta etapa. En el Reino Unido, la ley prohíbe el crecimiento de embriones más allá de los 14 días de desarrollo, momento en el que el embrión activa su programa de construcción corporal. Ese límite se impuso poco después de que la fertilización in vitro se hizo posible.
Pero algunos de estos modelos de embrión ya se asemejan a embriones en la etapa de desarrollo de 14 días. Dado que los modelos no se crean a través de la fertilización y nunca podrían dar lugar a una persona, algunos investigadores argumentan que no deberían estar sujetos a la regla de los 14 días.
En Estados Unidos, no hay una ley que prohíba el cultivo de embriones más allá de los 14 días, pero la enmienda Dickey-Wicker de 1995 prohíbe que los Institutos Nacionales de Salud de Estados Unidos financien investigaciones sobre embriones o células similares a embriones con "potencial organismal", dice Clark. Dado que estos modelos carecen de partes críticas, no tienen potencial para desarrollar un organismo, por lo que se puede financiar la investigación con modelos de embrión.
La sociedad internacional de células madre ha actualizado recientemente sus pautas, sugiriendo que si los científicos desean cultivar embriones creados por fertilización durante más de 14 días, deben buscar la aprobación pública en su jurisdicción. Dado que los modelos no son embriones, las pautas de la sociedad sugieren que pueden ser cultivados hasta que aparezca una estructura llamada línea primitiva, que indica que el embrión está comenzando a formar el cuerpo.
El objetivo para la mayoría de los científicos en el campo es comprender el proceso por el cual las células ensamblan un embrión y luego crean todos los órganos y tejidos del cuerpo, dice Martinez Arias. No es necesario ni deseable, y tal vez ni siquiera posible, construir una réplica perfecta de un embrión. "Ciertamente no creo que eso sea algo que queramos hacer, ni que debamos hacer o decir", dice. "Y eso no es algo que esté en el horizonte".
Aun así, los científicos necesitan detenerse y evaluar a fondo las estructuras similares a embriones y determinar cómo pueden ayudar a comprender el desarrollo humano, dice Martinez Arias. "Espero que ahora todos podamos desarrollar estos sistemas de manera que sean útiles para la investigación, en lugar de tratar de ver qué tan lejos en el espacio podemos llegar, sin pensar en cómo regresar".
Las conversaciones con el público sobre lo que los modelos de embrión representan científicamente, filosóficamente y legalmente, y sobre cómo usarlos éticamente, deben comenzar ahora, dice Hasson. "Debemos pensar en ellos ahora porque no es el caso, y no debería ser el caso, que los límites técnicos de lo que los científicos pueden hacer actualmente con estos modelos definan la discusión ética y cuáles deberían ser los límites éticos".
Nuestra misión es proporcionar noticias precisas y atractivas sobre ciencia al público. Esa misión nunca ha sido más importante que hoy.
Como organización de noticias sin fines de lucro, no podemos hacerlo sin ti.
Your support enables us to keep our content free and accessible to the next generation of scientists and engineers. Invest in quality science journalism by donating today.




