Mapear la evolución del principal factor de virulencia de E. coli ofrece un objetivo de medicamento refinado.
15 de junio de 2023
Este artículo ha sido revisado de acuerdo con el proceso editorial y las políticas de Science X. Los editores han destacado los siguientes atributos mientras aseguran la credibilidad del contenido:
- verificación de hechos
- publicación revisada por pares
- fuente confiable
- corrección de pruebas
por el Instituto Sanger de Investigación del Bienestar
En un nuevo estudio, publicado hoy en Nature Communications, un equipo multicéntrico liderado por el Instituto Sanger de Investigación del Bienestar, la Universidad de Oslo, Imperial College London y UCL, ha mapeado por primera vez la línea de tiempo evolutiva y la distribución de la cápsula externa protectora de Escherichia coli, responsable de la virulencia de la bacteria. El estudio también muestra cómo atacar la capa protectora de la bacteria puede ayudar a tratar infecciones extraintestinales.
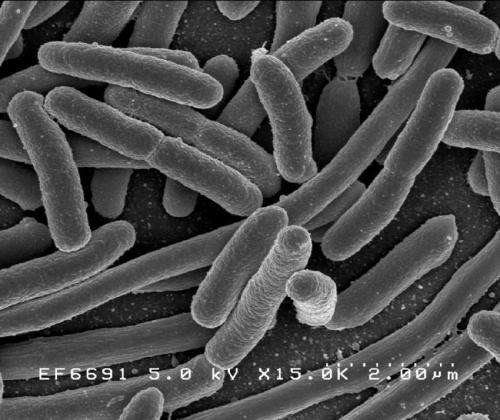
Este nuevo trabajo se centró en un subconjunto particular de E. coli con una cápsula específica, la barrera extracelular que rodea a una bacteria, que los científicos han llamado K1. E. coli con este tipo de cápsula son conocidas por causar enfermedades invasivas como infecciones sanguíneas o renales, y meningitis en recién nacidos. Esto se debe a que esta cubierta en particular les permite imitar moléculas ya presentes en los tejidos humanos y entrar en el cuerpo sin ser detectados.
Los investigadores presentan evidencia de que atacar la cápsula puede ser utilizado como base de tratamiento, abriendo el camino para prevenir graves infecciones por E. coli.
E. coli es una causa común de infecciones del tracto urinario y sanguíneas y puede causar meningitis en recién nacidos prematuros y a término, con una tasa de mortalidad de hasta el 40%. Además, el aumento de E. coli hipervirulenta y multirresistente a los antibióticos durante la última década significa que el desarrollo de estrategias efectivas para prevenir y tratar E. coli ahora se ha vuelto urgente.
Entender la anatomía de la bacteria y cómo esto juega un papel en la causación de enfermedades es clave para la prevención de infecciones graves. Hasta ahora, los científicos carecían de conocimientos básicos sobre la prevalencia, evolución y propiedades funcionales de la cápsula K1, lo que limitaba su capacidad para combatir infecciones por E. coli.
Los investigadores del Instituto Sanger de Investigación del Bienestar, la Universidad de Oslo, Imperial College London y UCL han mapeado ahora la evolución de esta cepa de E. coli, su prevalencia y distribución. Utilizando la genómica de poblaciones de alta resolución, la secuenciación completa del genoma y herramientas computacionales avanzadas, analizaron 5.065 muestras clínicas de diferentes países y períodos de tiempo. Los datos incluyeron grandes colecciones de muestras del Reino Unido y Noruega, muestras generadas recientemente de adultos y neonatos de seis países, como Brasil, México y Laos, entre otros, y muestras de la era pre-antibiótica desde 1932 en adelante.
Encontraron que esta cápsula específicamente virulenta, K1, en realidad data de más atrás en el tiempo, aproximadamente 500 años antes de lo que se pensaba previamente. Esto destaca la importancia de la cápsula para la supervivencia de la bacteria y el papel de la barrera extracelular en el éxito de E. coli como la principal causa de infecciones extraintestinales.
Dr. Sergio Arredondo-Alonso, autor principal del estudio de la Universidad de Oslo y el Instituto Sanger de Investigación del Bienestar, dijo: 'Fue emocionante descubrir la posibilidad de reconstruir la historia evolutiva de la cápsula K1 durante el último medio milenio, y ver cómo los genes de la cápsula han sido adquiridos una y otra vez por muchos linajes diferentes de esta especie de patógeno a lo largo de los siglos. Como ni la prevalencia ni la historia de K1 se conocían, sentimos que entramos en un territorio verdaderamente desconocido y avanzamos significativamente en la comprensión de esta importante especie patógena'.
El estudio también muestra que el 25% de todas las cepas actuales de E. coli responsables de infecciones sanguíneas contienen la información genética necesaria para desarrollar la cápsula K1. Obteniendo una historia evolutiva completa de esta cepa permitirá ahora a los investigadores comprender cómo las bacterias obtienen el material genético responsable de la virulencia grave en primer lugar y analizar formas de combatirlas.
Al utilizar enzimas de bacteriófagos, que son virus que infectan y matan bacterias, los investigadores pudieron eliminar la barrera extracelular de la bacteria y hacerla vulnerable al sistema inmunológico humano. Los investigadores demostraron en estudios in vitro utilizando suero humano, una parte líquida de la sangre que se utiliza comúnmente en estudios de laboratorio, que atacar esta cápsula puede ser una forma de tratar ampliamente la infección por E. coli sin el uso de antibióticos, lo que es consistente con infecciones experimentales previas en animales.
Dr. Alex McCarthy, a senior author of the study from Imperial College London, said, 'We specifically demonstrated the advances made possible by combining experimental microbiology with population genomics and evolutionary modeling tools, to open a window into translating the findings into future clinical practice. We show that therapeutic targeting of the K1 capsule makes these pathogens more vulnerable to our immune system, and offers the possibility of preventing serious infections. For example, it could help treat newborn babies with meningitis caused by K1 E. coli, which is a rare but dangerous condition associated with high mortality and serious long-term adverse health effects.'
Professor Jukka Corander, a co-senior author of the study from the Wellcome Sanger Institute and the University of Oslo, said, 'Our research shows the importance of representative genomic surveys of pathogens over time and space. These studies will enable us to reconstruct the evolutionary history of successful bacterial lineages and pinpoint changes in their genetic make-up that can lead to their ability to spread and cause disease. Such knowledge is ultimately providing the basis for designing future interventions and therapies against these pathogens.'




